神経細胞の活動電位と振動
脳波と分類
神経細胞の活動は細胞外活動電位を発生させ(spiking activity)、その集合は振動(oscillation)性の局所集合電位(local field potentials)となり神経回路内や神経回路間の伝達や調整に寄与している。大脳皮質の局所集合電位は、表面(頭皮)から脳波として測定することができる。
脳波は、その周波数から以下のように分類される1,2)。
| 分類 | 周波数帯 | 関連する状態 |
| Gamma (γ) | 26-80 Hz | 意識や知覚 |
| Beta (β) | 13-25 Hz | 覚醒、能動的な思考 |
| Alpha (α) | 9-12 Hz | 覚醒、閉眼・瞑想 |
| Theta (θ) | 5-8 Hz | 浅い睡眠 |
| Delta (δ) | 1-4 Hz | 深い睡眠・昏睡 |
| Slow | <1 Hz |
脳波と年齢
小児は脳の発達途上であり、脳波も成人とは異なる。新生児ではslow振動優位であり、成長とともに周波数が増加し振動の振幅が低下する2)。例えば、生後2ヶ月まではsleep spindleと呼ばれる紡錘波を認める、3-5ヶ月頃から部位によっては周波数の低いalpha振動やtheta振動が出現し始める。3歳を過ぎると、aplha振動がより明らかとなり、slow振動は消失する2)。
小児における脳波の強度(power)に関しては、生後増加し、5-8歳頃をピークに低下、18-21歳頃にプラトーとなる3,4)。特に1歳以上では、若年成人や思春期と比較し強度が強いとされる3)。年齢によって異なる脳波の強度は、脳の発達に関連すると考えれられている3)。
パラメーター
Index
Bispectral Index Monitor (BIS, Medtronic Inc., Dublin, Ireland)やPatient State Index (PSI, Masimo Inc., Irvine, CA, USA)といった指標は、脳波図をリアルタイムで解析し、0-100の範囲で麻酔深度を表示させる。これらの数字を計算する方法は、それぞれの機器で異なる独自のアルゴリズムを用いている。例えば、BISはbeta振動の割合、脳波の同調、burst suppressionの比率の3つより意識レベルを計算している2)。
注意すべきは、これらの指標は患者の意識状態を正確に反映しているわけではないことである5)。例えば、徐振動が深麻酔を示すという仮定でつくられており、ケタミンや笑気といったNMDA受容体拮抗薬は速振動と関連するため、麻酔下でも高値を示す1,2)。逆に、デクスメデトミジンは徐振動を引き起こすため、数字が低くても容易に覚醒する1)。つまり、それぞれの麻酔薬が異なる神経回路・分子標的に作用し異なる脳波図を示すが、indexではこれを反映できない。
年齢による相違も問題である。成人ではbeta振動といった高周波数帯の強度(power)の増強は浅麻酔を表すが、小児では(特に1歳以上で)高周波数帯の強度が強いため、これらindexが高値になりやすい3)。特に吸入麻酔薬で有用性は低く6)、例えば1MACのセボフルラン投与下では年齢が低くなるに従いBISが上昇する7)。成人のデータを元にアルゴリズムを作っているこれらの指標は、小児に対して用いることはできない。
Raw EEG (Unprocessed EEG)
生データからその周波数(frequency)と振幅(amplitude)を完全に理解するのは容易ではないが、burst supressionや平坦脳波は判別しやすい。Burst suppression ratio (BSR)とは、5μV未満の振幅が5秒より長く持続する時間を60秒間の平均で算出したものである。その際、電気メスや動きによるアーチファクトがある場合は適切に評価できないので注意する。
小児では特にゲインを調整し、振幅のスケールを合わせる。1歳未満では10μV/mm、1歳以上では25μV/mmを推奨する8)。全身麻酔を受けた小児において平坦脳波は稀ではなく9,10)、術中低血圧と関連する10)。
Spectrum analysis
脳波の生データからそれぞれの周波数毎に抜き出して解析することで理解が深まる。Spectrumは、それぞれの周波数におけるエネルギーを定量化(時間波形から変換)したものである。縦軸が強度(power)、横軸が周波数となる。強度は振幅から計算される1)。また、全体の強度の中央値に一致する周波数を”median frequency”、全体の95%の強度が存在する上限の周波数を”spectral edge frequency95: SEF95” (90%ならSEF90)と呼ぶ。
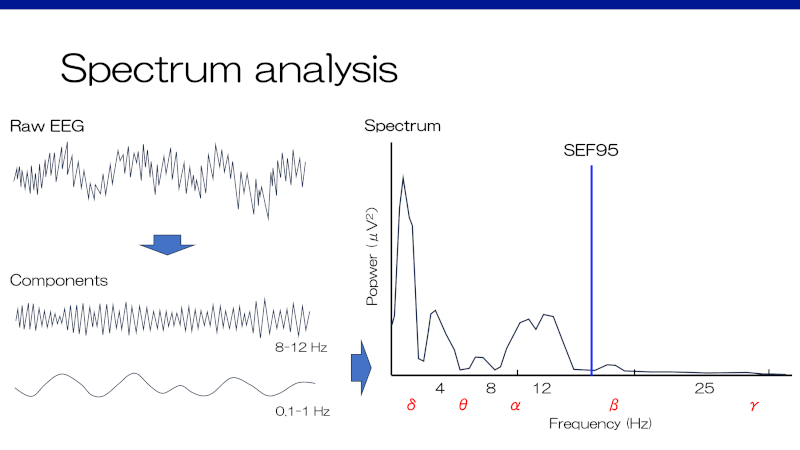
=参考=
麻酔レベル(プロポフォールの効果部位濃度:Ce)とSEF9511)
– 鎮静(Ce 2-3μg/mL):SEF95 15-20Hz
– 手術(Ce 3-4μg/mL):SEF95 10-15Hz
– 挿管(Ce 4-6μg/mL):SEF95 <10Hz
Spectrogramとは、spectrumを連続的にモニタリングすることで、時間による振動の変化や麻酔の影響をモニタリングすることが可能となる。時間・周波数・強度を三次元で表したものを、compressed spectral arrayと呼ぶ。また、横軸に時間、縦軸に周波数、色によって強度を表現(赤が強く、青が弱い)した二次元のグラフは、density spectral array (DSA)と呼ばれ、一般的にspectrogramとして用いられる。前述のように強度は年齢によって異なるため、適切なゲインに調整することが重要である。Burst suression出現時は、垂直の暗い線が認められる。
Coherence analysis
Coherenceとは、脳部位間でそれぞれ得られた脳波に含まれる周波数成分ごとの相関を表し、同周波数の同調を示している3)。
薬と作用機序
麻酔薬と振動
振動(oscillation)は、それぞれの脳内システムや回路内・間の脳活動のタイミングや同調を司る。麻酔薬は、特徴的な振動(oscillation)を引き起こすことでこの同調性を変化・阻害し、意識状態を変化させると考えられている1,3)。
1歳以上では成人と類似したspectrumとcoherenceを示すため、薬剤と年齢を考慮した上で成人と同様の麻酔維持アプローチ法が可能であり、むしろpowerが強いため成人よりも判別しやすい3)。しかし、(6ヶ月〜)1歳未満ではそれぞれの周波数帯の強度もcoherenceも異なる12)ことから、新生児や乳児に対する麻酔と脳波の指標についてはこれから研究が必要である。
プロポフォール
プロポフォールは、様々な脳内部位においてシナプス後のγ-aminobutyric acid type A (GABAA)受容体に結合し、内向きクロール電流から過分極を引き起こし神経細胞を抑制する1)。GABA受容体に作用する麻酔薬による脳波の変化は、(burst supressionや平坦脳波以外は)生理学的な睡眠による変化と似ている2)。
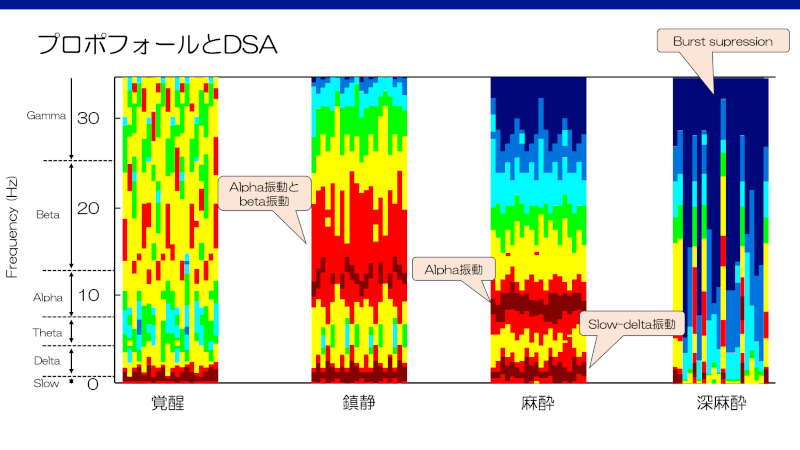
- 開眼覚醒時はbeta振動とgamma振動を認める1)。
- 麻酔薬投与にも関わらず活動性のbeta振動が出現する、paradoxical excitation。
- (声掛けには応じる程度の)鎮静ではalpha振動とbeta振動が認められる
- 全身麻酔レベルになると、slow-deltaとalpha振動が観察される1)。Alpha振動は閉眼覚醒時に後頭部で観察されるが、意識の消失と共に前方方向に一様に(coherent)広がる1)。Alpha振動帯のcoherenceを認めるが、slow振動帯のcoherenceは認めない13)。
- さらに麻酔が深くなると(麻酔導入時のボーラス投与時など)、alpha振動が消失しslow-delta振動のみとなる14)。電気活動と平坦脳波(isoelectricity)が交互に発生する”burst supression”が出現し、spectrogramでは垂直方向の線として認められる。
- さらに深くなると、昏睡や重症低体温のような平坦脳波(isoelectricity)を呈す。
- 覚醒に従い、slow振動とalpha振動が消失し、徐々にbeta振動とgamma振動が出現する。
1歳未満ではalpha振動の強度は周囲の周波数と比べて大きく変わらず目立たない4)が、症例によってはalpha周辺の広い範囲で強度が増加しているようにみえる11)。Alpha振動のcoherenceも明らかでない4)。1歳以上では、プロポフォール麻酔によるslow振動やalpha振動が認められ、年齢によって大きな差はない4)。
小児におけるプロポフォールによる麻酔の指標の一例8)
– 麻酔導入(挿管)
・DSA:delta周波数帯(0-4Hz)の高強度(赤色)とalpha-beta周波数帯(>10Hz)の低強度(青/緑)
・SEF:筋弛緩なしなら<10Hz、筋弛緩ありなら10-15Hz
– 麻酔維持
・DSA:slow-delta周波数帯(0-4Hz)とalpha周波数帯(8-12Hz)の高強度(赤色)
・SEF:10-15Hz
– 覚醒
・DSA:高強度がalpha振動(8-12Hz)からbeta振動(>12Hz)へ移行。
・SEF:>15Hzを目指し、>20Hzで自発呼吸があれば抜管。鎮静下抜管(Ce 2-3μg/mL)の場合はSEF 15-20Hzで抜管。
吸入麻酔薬
セボフルランによる振動は、プロポフォールと同様、GABA作動性回路を介在する13)。

- MAC未満の麻酔レベルでは、プロポフォールとよく似たalpha振動とslow-delta振動を呈する1,13)。
- MACレベル以上になると、theta振動が強く現れ、slow振動からalpha振動まで広く強度が出現する1)。Alpha振動の周囲(theta-alpha(-(beta))全体に出現する強い強度は、プロポフォールとの違いである13)。
- Alpha振動帯のcoherenceを認めるが、slow振動帯のcoherenceは認めない13)。
- 高用量ではburst supressionが出現する。
- 濃度を下げると最初にtheta振動が消失する1)。覚醒時には、プロポフォールと同様、slow振動とalpha振動が、beta振動とgamma振動に置き換わる。
以上の変化は、他の吸入麻酔薬でも同様である1)。
新生児でもセボフルランによるdelta振動(1-4Hz)やslow振動(0-1Hz)が認められるが、(6ヶ月-)1歳未満では成人で特徴的なalpha振動もそのcoherenceも示さない3,15,16)。Theta振動は、6ヶ月未満でも麻酔が深すぎる場合に出現しうる15)。1歳を超えるとalpha振動やそのcoherenceが認められる3,16)。
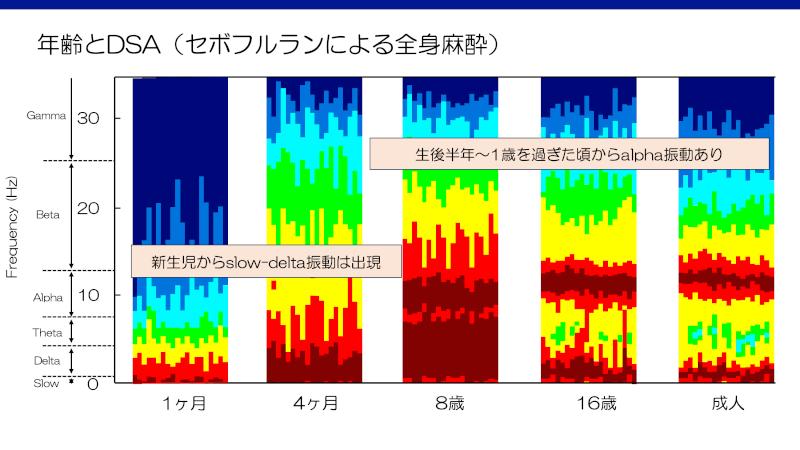
小児におけるセボフルランによる麻酔の指標の一例14)
– SEF10-15Hzを目標とする17)
– DSAをガイドに
・Burst suppression –> セボフルラン30%減量
・delta振動のみ –> セボフルラン20%減量
・delta振動、theta振動、alpha振動 –> セボフルラン10%減量
・delta振動、alpha振動 –> セボフルラン維持
・delta振動、alpha振動、beta振動 –> セボフルラン維持
・delta振動、beta振動 –> セボフルラン10%増量
ケタミン
ケタミンは、N-methyl-D-aspartate (NMDA)に結合し遮断することで効果を発揮する。皮質や皮質下神経回路の抑制性ニューロンを阻害するため、脳波は活動性を表す。すなわち、25-32Hzのhigh betaとlow gammaの速い振動(beta-gamma振動)が出現する一方で、slow振動はプロポフォールほどはではない1)。
デクスメデトミジン
シナプス前α2受容体に作用することで青斑核を過分極させ、ノルアドレナリンの放出を抑制する。鎮静レベルでは、slow-delta振動と、9-12Hzの振動(high alpha-low beta振動)が1-2秒続くspindleが出現する1)。Spindleのalpha振動はプロポフォールのalpha振動と周波数は似ているが、その強度は弱い1)。Slow-delta振動が出現し、さらに深くなるとspindleg消失しslow-delta振動の強度が強くなる1)。
References
- Purdon PL, et al. Anesthesiology. 2015 Oct;123(4):937-60. PMID: 26275092.
- Constant I, et al. Paediatr Anaesth. 2012 Jun;22(6):539-52. PMID: 22594406.
- Akeju O, et al. Br J Anaesth. 2015 Jul;115 Suppl 1(Suppl 1):i66-i76. PMID: 26174303.
- Lee JM, et al. Anesthesiology. 2017 Aug;127(2):293-306. PMID: 28657957.
- Avidan MS, et al. N Engl J Med. 2011 Aug 18;365(7):591-600. PMID: 21848460.
- Rigouzzo A, et al. Paediatr Anaesth. 2019 Mar;29(3):250-257. PMID: 30614153.
- Wodey E, et al. Br J Anaesth. 2005 Jun;94(6):810-20. PMID: 15833781.
- Yuan I, et al. Paediatr Anaesth. 2022 Nov;32(11):1252-1261. PMID: 35793171.
- Yuan I, et al. Anesth Analg. 2020 Feb;130(2):462-471. PMID: 31107263.
- Yuan I, et al. Anesthesiology. 2022 Aug 1;137(2):187-200. PMID: 35503999.
- Xu T, et al. Paediatr Anaesth. 2020 Dec;30(12):1299-1307. PMID: 32965066.
- Hayashi K, et al. Neurosci Lett. 2012 May 31;517(2):87-91. PMID: 22542892.
- Akeju O, et al. Anesthesiology. 2014 Nov;121(5):990-8. PMID: 25233374.
- de Heer IJ, et al. Minerva Anestesiol. 2023 Apr;89(4):351-358. PMID: 36799292.
- de Heer IJ, et al. Anaesthesia. 2019 Jan;74(1):45-50. PMID: 30367683.
- Cornelissen L, et al. Elife. 2015 Jun 23;4:e06513. PMID: 26102526.
- Han Y, et al. Brain Sci. 2022 Sep 5;12(9):1195. PMID: 36138931.
コメント