今回は、ファロー四徴症(Tetralogy of Fallot: TOF)根治術後の合併症の一つである、肺動脈逆流症と肺動脈弁置換術について、麻酔科医・集中治療医が把握すべき事項を解説します。小児期のTOFと、その姑息術や根治術に関しては、こちらをご覧ください。
TOF術後の合併症
TOF根治術の周術期死亡率は低下した一方で、残存病変や術後長期的な問題点が目立つようになってきた。TOF根治術後の合併症には、肺動脈逆流による右室拡張、心房中隔・心室中隔欠損の残存病変、三尖弁逆流、右室流出路瘤、肺動脈狭窄症(右室流出路、末梢肺動脈)、頻脈性不整脈(心房性・心室性)、大動脈拡大と大動脈弁閉鎖不全が挙げられる17, 18)。また、漏斗部の切開、筋束切除、肺動脈弁輪~肺動脈切開を施行することがあるTOF根治術では、右室流出路のakinesis/dyskinesisをきたし、右室自由壁の線維化や伝導遅延を引き起こす1)。多くの患者は20歳代から30歳代にかけて運動耐容能が低下し、心室性不整脈や突然死に至ることもある9,10)。
突然死(Sudden cardiac death)の危険因子17)
– 左室収縮・拡張機能傷害
– 持続しない心室頻拍
– QRS幅 >= 180 ms
– 広範囲な右室の瘢痕化
– 電気生理学検査で持続する心室頻拍
TOF術後の肺動脈逆流症
特に慢性的な肺動脈逆流は多くのTOF修復術後患者で問題となっており、肺動脈逆流量は以下の式で表すことができる1)。
PR volume = ROA * C * DT * (P2 − P1)0.5
※ROA: 逆流口面積, C: 定数, DT:拡張時間, P2 − P1:肺動脈と右室圧の拡張期圧較差
すなわち、逆流口面積が広く、拡張期時間が長く(←徐脈)、肺動脈と右室圧の圧較差が大きい程、逆流が増える。TOF根治術後、既に逆流口面積は比較的大きいことが多いが、肺動脈は径は小さく(→圧較差小)、拡張期も短いことから、当初は逆流は多くない。しかし、徐々に肺動脈や右室が拡張し、年齢とともに徐脈傾向になるため、逆流量は増えていく1)。
病態の進行
肺動脈逆流により、右室は1) 拡張期容量増加と肥大による代償期、2) 拡張期容量増加に対する肥大が追いつかない非代償期、3)(容量負荷を取り除けば改善する)可逆性収縮能低下、4) 不可逆性心筋傷害と線維化、と病状が進んでいく1,9)。また、右室と左室の機械的相互作用により、左室の収縮機能も低下する7)。
方針
外科的肺動脈弁置換術
肺動脈逆流症の管理と手術適応は、成人先天性心疾患の中でも大きな議論がなされている領域の一つである。一般的に、重症肺動脈逆流症に起因する症状のあるTOF修復術後患者は、肺動脈弁置換術の適応である。しかし、無症候性の肺動脈逆流症に対して、いつどのような介入を行うかは未だに答えが出ておらず、肺動脈弁置換術による症状改善以外の有効性の解明が重要である。
肺動脈弁置換術により、QRS幅の短縮、右室サイズの縮小、左室収縮機能の改善効果が報告されている8)。不可逆性な機能不全に至る前の手術が重要11)であり、手術のタイミングの指標として、術前の右室拡張末期容量指標や右室収縮末期容量指標が用いられている。当初は右室拡張末期容量指標 >170mL/m2や右室収縮末期容量指標 >85mL/m2が提唱された12)が、近年ではより早期の手術を支持するような値も用いられている9)。未だ議論中ではあるが、TOF修復術後の肺動脈逆流(±肺動脈狭窄)に対する外科的肺動脈弁置換術の適応には、以下のようなガイドラインや推奨が報告されている。
| ACC/AHA (2018)17) | ESC (2020)18) | CCS (2022)19) | Geva (2013)20) | |
| 肺動脈弁逆流 | – | 重度(逆流率 >30-40%) | 重度(逆流率 > 25%) | 中等度〜重度(逆流率 ≥ 25%) |
| 症状・運動耐容能 | 進行性の運動耐容能低下 | 進行性の運動耐容能低下 | 客観的な運動耐容能低下 | 症候性(ex. 運動能低下、心不全症状、不整脈による失神)の患者では下記の1つ以上、無症候の患者では2つ以上 |
| RVEDVI | 重度右室拡大(RVEDVI ≥160mL/m2 or RVEDV/LVEDV ≥2) | 進行性の右室拡大(RVEDVI ≥160mL/m2) | RVEDI ≥160mL/m2 | RVEDI >150mL/m2 or z score >4 (※体表面積が正常範囲外であればRVEDV/LVEDV >2) |
| RVESVI | RVESVI ≥80mL/m2 | RVESVI ≥80mL/m2 | RVESVI ≥80mL/m2 | RVEDI >80mL/m2 |
| 右室機能 | 軽度〜中等度 | 進行性の収縮機能低下 | – | 右室駆出率 <47% |
| 左室機能 | 軽度〜中等度 | – | – | 左室駆出率 <55% |
| 三尖弁逆流 | – | 進行性の中等度以上の三尖弁逆流 | – | 中等度以上の三尖弁逆流 |
| QRS幅 | – | – | – | >160ms |
| 不整脈 | – | – | 持続する心室性不整脈 | 右心負荷による持続する頻脈 |
| 右室流出路狭窄 | 右室圧 >= 2/3*体血圧 | 症候性:中等度(Peak velocity >3m/s) 無症候性:右室圧 >80mmHg | 右室圧 > 2/3*体血圧 | – |
| その他 | – | – | – | ・右室流出路瘤 ・体血圧の0.7倍以上の右室圧を伴う右室流出路狭窄 ・カテーテル治療で改善しない肺動脈分枝の狭窄 ・心房・心室中隔欠損によるQp/Qs≥ 1.5 ・重症大動脈弁逆流症 |
経カテーテル肺動脈弁留置術
肺動脈弁の留置には、再開胸による外科的肺動脈弁置換術が行われてきた。しかし、手術回数が増えると術後出血や低心拍出量症候群、不整脈といった合併症が増え、死亡率増加と関連する14)。最近では経カテーテル肺動脈弁留置術(Percutaneous pulmonary valve implantation: PPVi)も行われている。
経カテーテル肺動脈弁留置術には、弁留置や基礎心疾患にまつわる合併症がある。冠動脈閉塞は、特に解剖学的異常冠動脈で特に注意すべき合併症である15)。右室流出路のバルーン拡張とステント、弁留置時には、圧迫による冠動脈閉塞の有無を、冠動脈選択造影を行い評価する。右室流出路のバルーン拡張は、大動脈基部の捻れや圧迫を引き起こし、大動脈弁閉鎖不全を引き起こしうる16)。また、弁塞栓、右室流出路の導管破裂や解離、三尖弁の損傷、肺動脈閉塞、ワイヤーによる肺損傷など、稀ではあるが緊急開胸手術を要する合併症を起こす危険がある。
術前評価
失神、年長での根治術といった現病歴、QRS延長や心室頻拍の存在は、修復術後の予後(死亡、心室性不整脈、心不全といった”adverse events”)予測因子となるためチェックしておく1)。右心不全による肝機能低下症例では、腹水や低アルブミン血症による血管内容量の低下、凝固障害にも注意する。また、心臓超音波検査、心臓CT、核医学、心臓カテーテル検査、そして心臓MRIが、TOF術後・肺動脈弁置換術前の心機能を評価に用いられている。以下、その代表を列挙する。
逆流率(regurgitant fraction)
Cardiac MR (CMR)で計測することができる。<20%で軽度、20-40%で中等度、>40%で重度とされる2,3)。
右室拡張末期容量指標(RV end-diastolic volume index: RVEDVI)
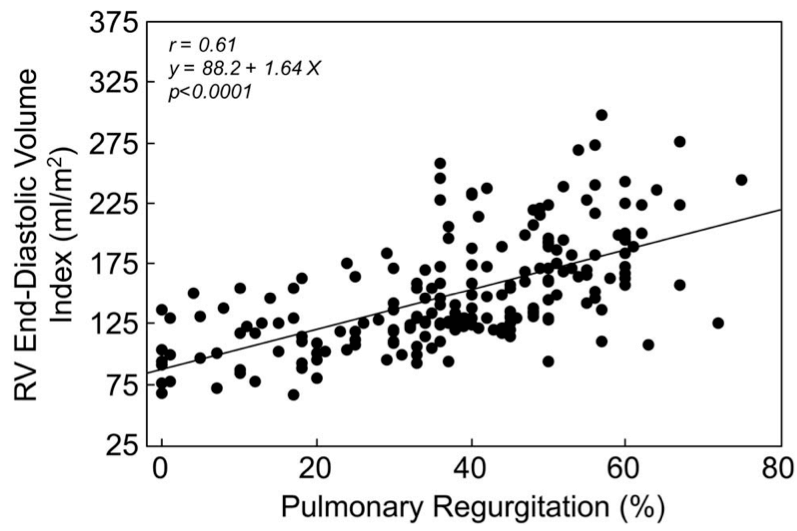
CMRで計測。肺動脈逆流による右室拡張の指標であり、肺動脈逆流の重症度や弁置換の適応(ex. >150-170 ml/m2)1,2,9)、術後リモデリング(ex. <100 ml/m2)2)の指標に用いられる。正常値<=108 ml/m2。4)
Figure. TOF術後患者における肺動脈逆流とRVEDV indexの関係1,5)
右室収縮末期容量指標(RV end-systolic volume index: RVESVI)
CMRで計測。近年、拡張期だけでなく収縮期容量も重要であると指摘されている。RVEDVと同様、肺動脈逆流の重症度や弁置換の適応(ex. >80-90 ml/m2)1,9)、術後リモデリングの指標(ex. <55 ml/m2)2)に用いられる。正常値<=47 ml/m2。4)
右室駆出率(RV ejection fraction)
CMRでも計測可能。前述の通り、肺動脈逆流の病状進展とともに低下する。弁置換の適応(ex. >47%)1)、術後リモデリングの指標(ex. >50 %)2)に用いられる。正常値>50%4)。
Figure. TOF術後患者におけるRVESVとRVEFとの関係1,6)
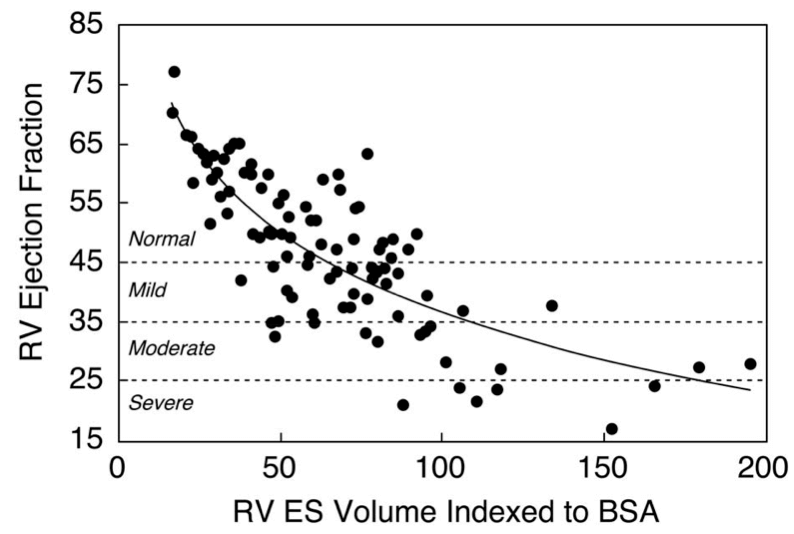
※容量負荷による右室拡張に対する代償(肥大)がなくなると、収縮末期容量は増加し、駆出率は低下する。
QRS幅
右室の伝導路は長い一本の線維束からなり、基部から漏斗部末梢の自由壁までの活性化に遅れが生じる。漏斗部の切開、筋束切除、肺動脈弁輪~肺動脈切開を施行することがあるTOF根治術後は、伝導路の遅れが起こり、QRS幅が延長する。
前述のように、このQRS延長は重症度を表すマーカーとして知られており、>180ms (4.5マス)をカットオフとしている研究が多い。
術中管理
外科的肺動脈弁置換術
TOF修復術後の外科的肺動脈弁置換術は、再開胸とのため出血への備えが必要である。太い末梢静脈路だけでなく、必要に応じて中枢にブラッドアクセスやシースの留置を考慮する。前述のようにTOF修復術後患者では右心負荷から心室性不整脈に至る症例があり、麻酔導入時に除細動パッドを貼っておく。通常は胸骨正中切開により心臓へアプローチするが、胸骨と大動脈や心外導管との位置関係次第では、大腿動静脈からの人工心肺確立を考慮する。そのため、心臓に近い動脈(通常は右橈骨動脈)に動脈圧ラインを確保し、脳組織酸素飽和度のモニタリングも欠かせない。術前より心房性・心室性不整脈をきたしやすい患者群であり、麻酔導入時や術中の心電図変化やバイタル変化に注意する。
経食道心エコーで、肺動脈弁の逆流、主肺動脈の拡張期逆流波と逆流時間、左右肺動脈の逆流波、右室拡張末期容量、右室や左室の収縮機能をチェックする。
右心不全が病態の中心であり、右室収縮機能低下に加え、肺動脈逆流の存在により右室流出路から肺循環に入る有効心拍出量が低下している。心血管作動薬による循環補助が有効であるが、右室流出路狭窄病変が残存している症例やカテコラミンによる心室性不整脈には注意する。肺動脈逆流症により右室は拡大しており、過度な輸液は左室の圧迫や三尖弁逆流を増悪させる危険がある。逆流が主な病態であれば、拡張期時間と逆流量を増やすような過度な徐脈は避ける。また、肺血管抵抗の上昇も逆流の増悪に寄与するため、低酸素や高二酸化炭素、アシドーシスを避ける。
人工心肺離脱後も、出血は多くの患者で問題となる。外科的な止血が可能となるよう、適宜凝固機能を評価し輸血製剤を使用する。術後不整脈は血行動態を悪化させるため、電解質異常を来さないよう積極的に補正する。右室の後負荷を考えると早期抜管は有利に働くが、出血や心機能低下、不整脈により血行動態が不安定であれば急がない。
経カテーテル肺動脈弁留置術
全身麻酔または局所麻酔(鎮静)で行われる。通常のモニタリングや動脈圧ラインの確保に加え、緊急開胸手術へ移行する可能性があるため太い静脈路確保や血液の準備が必要である。中心静脈路は、イントロデューサーシースの側管の使用または別に確保する。
術野で大腿静脈(または内頚静脈)と動脈のシースを挿入して手技が開始される。ヘパリンを投与しACT >250秒以上に維持する。右室流出路のバルーン拡張時には血圧が低下するが、拡張解除とともに自然と回復する。心室機能が低下している患者では、血管作動薬の投与が必要となる場合がある。心房性・心室性不整脈、ブロック、ST変化等、常に心電図変化に注意する。経カテーテル大動脈弁留置術(TAVI)と同様、特に重度な肺動脈逆流がある患者では、心拍出量を減らし弁のズレ(migration)を避けるために高頻拍ペーシング(rapid ventribular pacing)を要することがある。
バルーン拡張や弁留置時には、前述のように冠動脈圧迫、右室流出路破裂、心タンポナーデ、弁塞栓、三尖弁損傷による血行動態の破綻の可能性がある。すぐに血管造影や心臓超音波検査で原因検索を行い、それぞれへの迅速な対応が重要である。
References
- Geva T. J Cardiovasc Magn Reson. 2011 Jan 20;13(1):9. PMID: 21251297
- Alvarez-Fuente M et al. Pediatr Cardiol. 2016 Mar;37(3):601-5. PMID: 26687177.
- Mercer-Rosa L et al. Circ Cardiovasc Imaging. 2012 Sep 1;5(5):637-43. PMID: 22869820
- Therrien J et al. Am J Cardiol. 2005 Mar 15;95(6):779-82. PMID: 15757612.
- Samyn MM et al. J Magn Reson Imaging. 2007 Oct;26(4):934-40. PMID: 17896382.
- Geva T et al. J Am Coll Cardiol. 2004 Mar 17;43(6):1068-74. PMID: 15028368.
- Davlouros PA, et al. J Am Coll Cardiol. 2002 Dec 4;40(11):2044-52. PMID: 12475468.
- Ferraz Cavalcanti PE, et al. J Am Coll Cardiol. 2013 Dec 10;62(23):2227-43. PMID: 24080109.
- Kim YY, et al. Heart. 2016 Oct 1;102(19):1520-6. PMID: 27329296.
- Gatzoulis MA, et al. Lancet. 2000 Sep 16;356(9234):975-81. PMID: 11041398.
- Therrien J, et al. J Am Coll Cardiol. 2000 Nov 1;36(5):1670-5. PMID: 11079675.
- Therrien J, et al. Am J Cardiol. 2005 Mar 15;95(6):779-82. PMID: 15757612.
- Geva T. Circulation. 2013 Oct 22;128(17):1855-7. PMID: 24065609.
- Dore A, et al. Am J Cardiol. 1997 Oct 1;80(7):906-13. PMID: 9382007.
- Fraisse A, et al. Catheter Cardiovasc Interv. 2014 Jun 1;83(7):E260-8. PMID: 24619978.
- Lindsay I, et al. Catheter Cardiovasc Interv. 2016 Nov;88(5):814-821. PMID: 27121036.
- Stout KK, et al. Circulation. 2019 Apr 2;139(14):e698-e800. PMID: 30586767.
- Baumgartner H, et al. Eur Heart J. 2021 Feb 11;42(6):563-645. PMID: 32860028.
- Marelli A, et al. Can J Cardiol. 2022 Jul;38(7):862-896. PMID: 35460862.
- Geva T. Circulation. 2013 Oct 22;128(17):1855-7. PMID: 24065609.
コメント
コメント一覧 (3件)
[…] 肺動脈逆流症と肺動脈弁置換術 […]
[…] ファロー四徴症の長期的な問題点や合併症に関しては、『肺動脈逆流症と肺動脈弁置換術』参照のこと。 […]
[…] 術前術後のMRIで右室拡張末期期容量(RVEDV)・収縮期容量(RVESV)の変化を比較。 […]