以下、基本的にはファロー四徴症の根治術を念頭に、麻酔科医が把握すべき事項や麻酔管理について解説します。
解剖・分類
「大きなVSD」、「右室流出路狭窄」、「大動脈の右室流出路騎乗」、「右室肥大」の四徴を持つことから、ファロー四徴症(Tetralogy of Fallot: TOF)と呼ばれる。
VSDは通常大きく非制限性(unrestrictive)であり、右室と左室の圧較差はtrivialまたは殆どない。多くは膜様部周囲型VSDであるが、筋性型VSDが合併することもある12)。漏斗部中隔の前方偏位(anterior malalignment)するため、malalignment VSDとも呼ばれる12)。漏斗部中隔の前方偏位により、典型的には右室流出路の漏斗部(subvalvular)が狭窄するが、主肺動脈や動脈管・体肺動脈シャント吻合部位の左右肺動脈の狭窄(supravalvular)、肺動脈弁の弁性狭窄や弁輪の低形成(valvular)が合併することもある12,13,19)。
TOFには様々なvariantが存在し、最も一般的な肺動脈狭窄を伴う古典的なTOF以外にも、房室中隔欠損症を伴うTOF(Tetralogy of Fallot with atrioventricular septal defect: TOF/AVSD)、肺動脈弁欠損(Tetralogy of Fallot with absent pulmonary valve syndrome: TOF/APV)が存在する20)。また、「ファローの極型」と呼ばれる肺動脈閉鎖(PA/VSD)を含める専門家もいる。本章では、最も頻度の多い古典的なTOFについて扱う。
= 肺動脈弁欠損 =
肺動脈弁の異形成により胎内から肺動脈逆流が著名となり、主肺動脈や肺動脈分枝は瘤状に拡張する。出生後は血管が気道を圧迫し、気管気管支軟化症や呼吸不全の原因となる21)。
病態生理
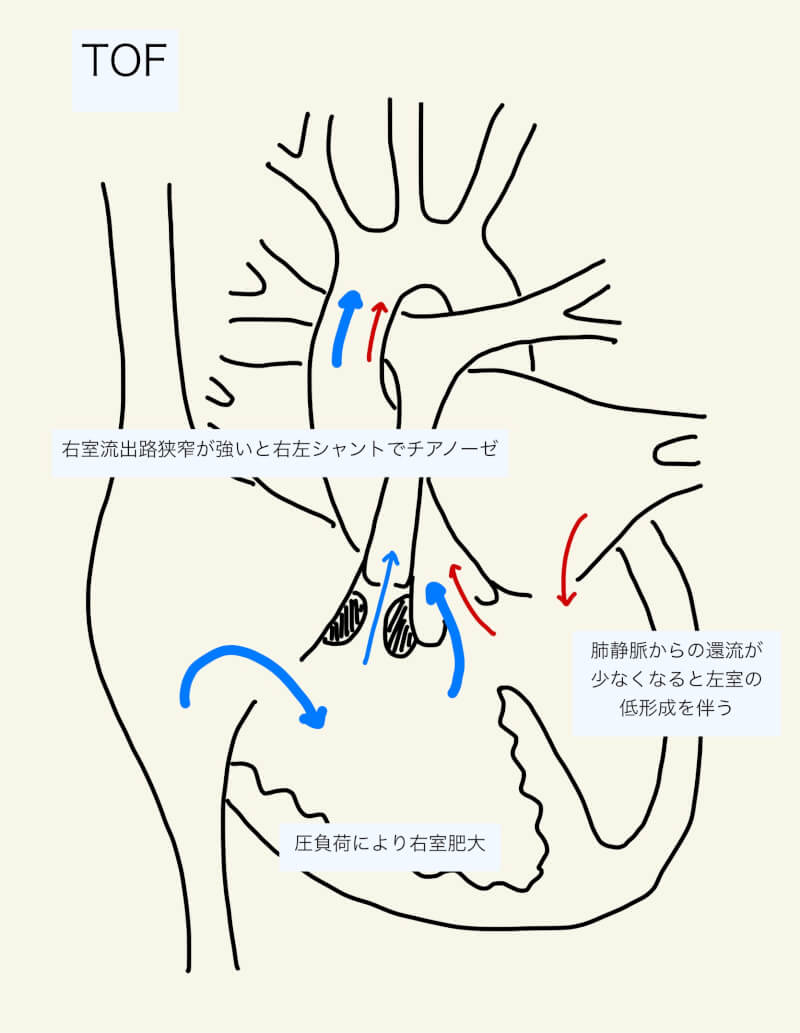
肺血流とチアノーゼ
症状の重症度は、酸素化されていない血液が全身循環へシャントする量を規定する右室流出路狭窄の程度に依存する。右室流出路狭窄が軽度の場合は酸素飽和度が正常(いわゆる”pink tets”)だが、大きな非制限性VSDを介した左右シャントから過剰な肺循環から心不全となる。
右室流出路狭窄が強い場合、大動脈が心室中隔に騎乗して右室側に偏位しているため、VSDを通した著明な右左シャントにより肺血流が低下し、重度のチアノーゼを引き起こす。右室流出路狭窄は、肺動脈低形成・狭窄といった変化のない静的要素と、肥大漏斗と筋束線維に起因し右室の圧負荷増加に反応して狭窄が悪化する動的要素が存在する1)。血管内容量が低下すると、相対的にこの静的狭窄が顕著になる。また、交感神経系や心収縮力を増加させると、動的要素による右室流出路狭窄が悪化する(spell発作)1)。
四徴の一つである右室肥大は右室流出路の狭窄を悪化させる。そのため、出生時は緊急の介入が必要でない患者であっても、数ヶ月から数年かけて右室が肥大することで狭窄が悪化し肺血流が低下する19)。無治療の場合、生後1年以内にspell発作の頻度は増加し、主な死因となる19)。
シャントとチアノーゼを考える上では、右室流出路狭窄の程度だけでなく、全身血管抵抗も大切である。そのため、全身血管抵抗が低下するような状況(低酸素やアシドーシス1))もまた、右左シャントを増加させチアノーゼを増悪させる。
右室肥大
VSDを介した体循環と右室流出路狭窄を介した肺循環という高い後負荷により、右室は肥大する。そのため、心拍出量を維持するために高い充満圧が必要となる。
左室低形成
右室流出路狭窄により肺血流が減少している場合、左心系への還流量が少なく左室の発育が悪くなる4)。
= 未治療のTOF =
近年、成人期まで放置されるTOFを見ることは少ない。古いデータではあるが、TOF手術歴のないTOF患者の平均寿命は12年25)とされ、66%の患者が1歳まで、49%が3歳まで、24%が10歳まで生存し、40歳以降まで生存できるのは3%のみである26)。未治療での長期生存に関与する因子は不明であるが、肺動脈低形成と徐々に進行する肺動脈弁下狭窄、左室肥大、動脈管開存などによる心外シャントの寄与が提唱されている27)。
未治療または姑息術後の患者では、長期の右左シャントによる慢性的なチアノーゼや奇異性塞栓、心筋障害、心室性・心房性不整脈が問題となる28)。長期間のチアノーゼや高圧へ曝露された右室は、心筋の線維化や拡張障害をきたし、周術期の右心不全の危険性が高まる29)。肺血流が減少しているため、肺血管の低形成や不十分な肺血管床が問題となる。また、長期のチアノーゼは血小板や凝固異常を引き起こす30)だけでなく、肺動脈肺動脈側副血管を含めた豊富な血管新生の原因となり、周術期出血のリスクを高める。また、成人期のTOF患者は、乳児期のTOF患者と比べ、周術期の心房細動や心室頻拍などの不整脈発生率が高い28,29)。
方針
姑息術
患児が小さく(一つの目安は1ヶ月 or 4 kg1))、症状がある場合には、シャント術を施行し、二期的の修復術を狙う。
根治術
根治術を行う時期については、未だ議論が続いている。無症候性の待機手術であれば3ヶ月〜6ヶ月での根治術で予後が良いとされている9)が、1〜3ヶ月という乳児早期の手術でも良好な成績を残している施設もある1,9)。早期の根治術は未熟な脳や臓器への人工心肺の影響や技術的難易度の面で不利であるが、低酸素による脳への影響や増加するspell発作の危険、右室肥大の進行を防げるといった面では利がある19)。ただし、複数のVSD、冠動脈の走行異常、肺動脈発育不良といった因子があれば、姑息術を施行し成長を待つ1)。
多くの場合、transatrial-transpulmonary approachが行われる。主肺動脈を切開し(←transpulmonary)肺動脈弁を観察し、必要があれば切開術(commissurotomy)が施行される1)。主肺動脈-肺動脈分岐部の狭窄はpatchで拡大する。肺動脈弁輪径がある程度あれば、弁を温存する(valve-sparing)。肺動脈弁輪が小さい場合には、弁輪から右室自由壁にかけて縦に切開され、transannular patchが用いられる。また、へガールを用いて右室流出路や主肺動脈の大きさを確認する。右房・三尖弁経由(←transatrial)で右室流出路を観察し、漏斗部中隔を切除、心室中隔欠損を閉鎖する。可能な限り右室の心室切開(ventriculotomy)を避けるが、患者が小さく狭窄が強い場合は必要となることがある8)。
Table. それぞれの利点と欠点7)
| Procedure | 利点 | 欠点 |
| Pulmonary valve sparing |
•↓PR
•↓RV dysfunction
|
•↑ Immediate risk
•↑ Residual stenosis risk (reintervention)
|
| Transannular patch |
•↓PV reintervention
•↓ Immediate risk
•↓ Residual stenosis risk
|
•Free PR
•↑ RV dysfunction
•↑ PV reintervention
|
術後の右室拡張不全が強いと予想される患者(ex. 症候性の新生児)に対しては、心房間交通を作る(または残存させる)ことにより、酸素化を犠牲にして心拍出量を優先する(”pop off” valve)こともある9)。
術前チェック項目
麻酔科医として、最低限以下の項目については術前に把握しておく。
心超音波検査
右室流出路狭窄の部位と程度
TOFの重症度判定のため、右室流出路狭窄の程度を把握する。流速(m/sec)や圧較差(mmHg)で表現する。
| Degree of obstruction | Doppler velocity | Gradient across RVOT/PV |
| Mild | < 3 m/s | < 36 mmHg |
| Moderate | 3 – 4 m/s | 36 – 64 mmHg |
| Severe | > 4 m/s | > 64 mmHg |
Continuous wave Dopplerでは、典型的な漏斗部の狭窄病変ではdynamic obstructionの特徴として収縮後期にvelocityのピークがある“dagger-shaped”を呈する11,13)。肺動脈弁や主肺動脈・左右肺動脈に狭窄があれば、fixed obstruction(小さな弁輪や肺動脈)の特徴として収縮中期にピークのある対称性の波形となる11)。Dynamic obstructionとfixed obstructionの併存で“ double envelop”が観察できることもある。
左室拡張末期容量
前述のように、右室流出路狭窄により肺血流が減少している場合、左心系への還流量が少なく左室の発育が悪くなる4)。左室の発育は、人工心肺離脱後や術後管理上、非常に大切な指標である。左室拡張末期容量を、正常値と比べたpercentage(%)で評価し、80%以下であれば注意を要する。
冠動脈の走行
TOF患者の5-12%に、冠動脈異常がみられる1)。異常や冠動脈の走行によっては、外科的手術方法や手術のタイミングに影響を与える。例えば、左前下行枝が右冠動脈から分岐し右室流出路を横切るような走行をしている場合、冠動脈を避けた心室切開や右室肺動脈導管が必要となることがある9)。
肺動脈・肺動脈弁の形態、狭窄
肺動脈弁や肺動脈の異常もまた、右室流出路狭窄に寄与する。二尖弁や肺動脈低形成(主肺動脈と肺動脈分枝)があれば外科的に介入することがあるで、術前の評価を忘れずに。
その他
VSDのサイズと部位(上述の通り筋性型VSDが合併することがあるが、膜様部周囲型の大きなVSDの存在や新生児の肺高血圧の存在下では診断しにくい)、シャントの方向(シャントの方向はRVOTOの程度に依存。非制限性VSDで両心室の圧が等しいためシャントは両方向性のことが多いが、RVOTOが中等度から重度であれば主に右左シャント)、三尖弁逆流(VSDのパッチ閉鎖により引き起こされる)、ASDといった他の心内病変も把握しておく。
カテーテル検査
TOFであれば術前にカテーテル検査を施行されていない症例もあるが、もし施行されていれば以下の所見をチェックする。
肺動脈圧と右室圧
右室流出路狭窄の程度を表すため、肺動脈圧と右室圧の圧較差を把握する。非制限性VSDのため、右室圧は上昇している。
PA index
根治術を行うためには、生後肺血流がある程度保たれ、肺血管が発育していることが必要である。肺動脈の発育の指標であるPA indexが200mm2/m2あれば、ある程度発育していると考えられるが、それ以下であれば根治術の適応外として短絡手術を行うことがある。術後肺高血圧や右心不全の危険因子として把握しておく。
冠動脈の走行
超音波検査のみでは冠動脈の走行が不確かな場合は、大動脈基部や選択的冠動脈血管造影が行われることもがある1)。
周術期管理
シャントの麻酔管理に関しては、こちらの記事を参照のこと。以下、根治術を念頭に解説する。
麻酔導入・維持
血行動態
患者は、年齢・体重・肺動脈の発育・左室の発育といった観点からBTシャントといった姑息的シャント術を施行されている患者と、姑息的シャントのない未治療患者に分けられる。姑息的シャントのない患者では、spell発作が起きた際に肺血流が著明に減少するため、チアノーゼと低酸素の悪化により循環が虚脱し、致命的となる。
Spell発作はいつでも起こり得るが、特に麻酔導入中(交感神経緊張性の低下とともに相対的に血管内容量が低下し、末梢血管抵抗が低下)と外科的刺激に特に注意する。術前の絶食期間が長く右室の前負荷が低下している患者や、プレメディケーションせずに緩徐導入に非協力的な患児では危険が増す。肺血流が低下するため、突然酸素飽和度が低下し、呼気二酸化炭素濃度が低下する。
麻酔管理としては、右室流出路狭窄を悪化させず、血管内容量を保ち、全身血管抵抗を保つことで、右左シャントを減らす努力をする。
- 輸液:右室を充満・右室流出路狭窄を軽減させ、心拍出量と体血圧を増加させる。TOFの右室流出路狭窄に対する治療としては、第一選択となる。例えば、5%アルブミンを5~10ml/kgボーラス投与する。重症例では麻酔導入と同時に予防的に投与することもある。
- フェニレフリン5-10μg/kg(1mg/生食20mlに希釈し、0.1-0.2ml/kg)を投与し、全身血管抵抗を増加させる。フェニレフリンは他のカテコラミンと異なり心収縮力を増加させないため右室流出路の狭窄を悪化させず、静脈系の血管収縮により右室の前負荷を増やす効果も期待できる。
- 揮発性麻酔薬による麻酔を深くすることで、陰性変力作用による漏斗部攣縮を減弱させることができる1)。ただし、揮発性麻酔薬は体血管抵抗も低下させるので注意を要する。麻薬と上手く組み合わせる必要がある。
- 吸入酸素濃度の増加、過換気:末梢循環不全や低換気によるアシドーシス、肺血管抵抗の上昇を防ぐため、吸入酸素濃度を増加させ、過換気とする。すなわち、新生児など肺血管抵抗が高い場合に特に有効であるが、右室流出路や肺動脈弁の狭窄に対してはあまり効果的ではない。ただし、高酸素は体血管抵抗を増加させる22)という点では、spellに対して有効であるかもしれない。
- 蹲踞(squatting):麻酔導入時であれば、両下肢を腹部(胸部)に押し付けることで腹腔内圧が上昇し、右室の前負荷増加と体血管抵抗の上昇が期待できる。腹部大動脈の用手圧迫も体血管抵抗を増加させる24)。
- エスモロール(50-200μg/kg)やプロプラノロール(0.1mg/kg)、ランジオロールといったβ遮断薬により漏斗部攣縮を抑制する方法もある1)が、麻酔中や集中治療室での重症症例に対するβ遮断薬のボーラス投与は著明な血圧低下を引き起こすことがあるため、他の治療を先に試した方が良い。
- 重炭酸ナトリウムやTHAM:アシドーシスは肺血管抵抗を上昇させるため、アシドーシスは積極的に補正する。
- 外科的介入:外科的刺激により重症発作が起きた場合には、外科医に肺動脈周囲の処置を一時止めてもらう。また、大動脈の外科的圧迫し一時的に全身血管抵抗を増加させる方法もある1)。
上記の介入でも改善がみられなければ、人工心肺を考慮する。麻酔導入時にプライミングして準備しておくことが患者を助ける。外科医としては出血を減らす意味でも、できる限りヘパリンを投与する前に剥離をすすめるが、麻酔科的な介入で駄目なら早めに臨床工学技士に連絡し、人工心肺への移行を外科医に提言することが大切である。
経食道心エコー
術前の心超音波検査で評価された項目について、もう一度経食道心エコーでも評価する。最低限、
- 右室流出路狭窄の部位と程度
- 肺動脈・肺動脈弁の形態
- VSDの位置と大きさ
- 三尖弁逆流:VSDのパッチ閉鎖により術後出現することがあるので術前からチェック。
- その他の心内病変の有無
はチェックしておく。
人工心肺離脱後
左心不全
修復後は、左室に流入する血液量が増えるが、前述のように左室は低形成傾向にあり、急な容量負荷に耐えきれなくなることがある。術前左室が小さい場合は、心拍数を増加させて心拍出量を保つため、TOF根治術後患者では心拍数を低下させる薬剤(デクスメデトミジンetc)の不用意な使用を控えるようにする。胸腔内圧の上昇は、transmural pressureを低下・後負荷を軽減させ、前負荷を低下させるため、(後述の右心不全と異なり)陽圧換気は有利に働く。
右室不全
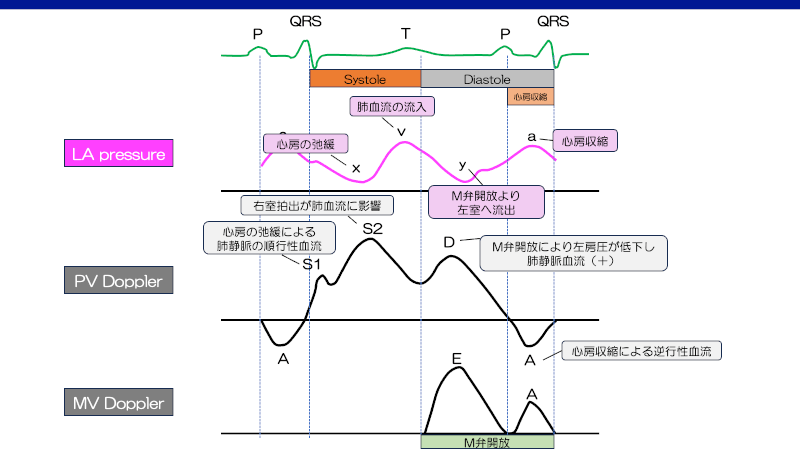
術前に肺血管の発育が乏しい場合や、右室切開や肺動脈弁下の過剰な筋切除といった術中の外科的要因、人工心肺の影響による肺血管抵抗上昇や、残存右室流出路狭窄により、術後右心不全傾向となる。特に、ファロー術後は右室拡張不全(RV restrictive physiology)を呈する症例があり、心エコーでは心房収縮期の肺動脈への血流が認められる(右室が拡張後期に拡張できずただの導管となる)2)。
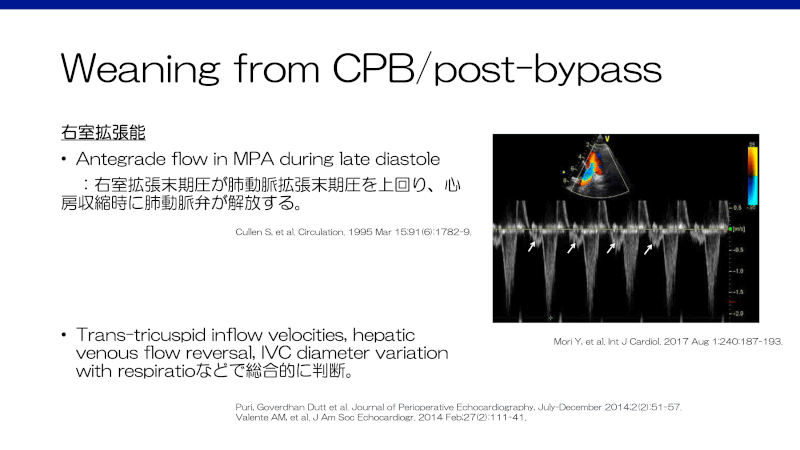
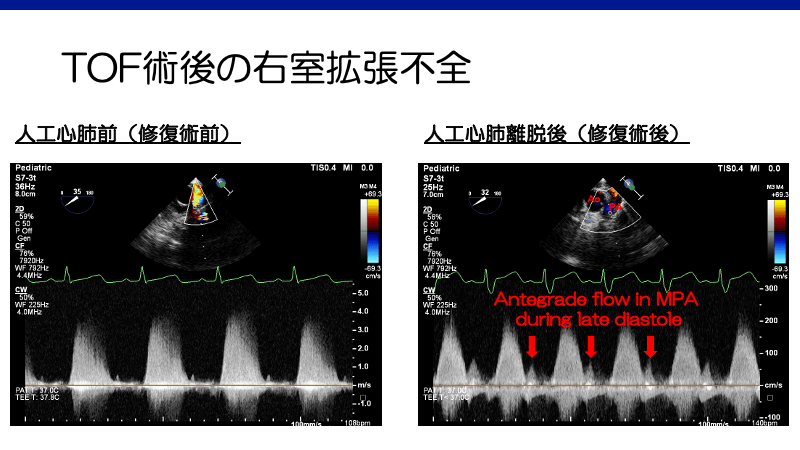
この心房収縮期の肺血流が心拍出量にとって非常に大切となるため、ある程度の充満圧(ある程度高いCVPは許容)や洞調律の維持が重要となる。また、頻脈は拡張時間が相対的に減少しコンプライアンスの悪い心室が弛緩できなくなるため、拡張不全の患者では頻脈を避ける必要がある。右心不全や肺高血圧に対する一般的な治療(心拍出量を維持するための充満圧、高酸素、低二酸化炭素、アシドーシスの回避、場合によってはNOなど)を考慮する。上記左心不全と異なり、自発呼吸は右室の後負荷を軽減させ、静脈還流を増加させ右室の充満を助けるため、抜管により循環動態は改善する3)。術後右室拡張不全は通常2週間以内に改善する10)。
Transannular patchが施行された症例では、肺動脈逆流量を最小限に肺へのforward flowを維持することが重要であり、ここでは頻脈は利に働く。また、酸素投与や過換気、肺高血圧治療薬によって肺血管抵抗を低下させることは、逆流量を減らすためにも有用である。Valve-sparingによって肺動脈弁を温存し狭窄病変が残っている場合は、やや徐脈傾向で前負荷と心室の拡張時間を維持する。
ミルリノンといったPDE阻害薬は、心筋の弛緩の改善(lusitropy)、収縮力増加(inotropy)、後負荷軽減(vasodilation)作用があり、特にカテコラミンへの反応性の悪く後負荷の影響が強い新生児に有用である。また、残存右室流出路狭窄が強い場合には、強心剤が悪影響を及ぼす可能性があるため、場合によっては強心剤フリーで人工心肺から離脱することも考える。
残存病変
上記の他にも、残存VSDの有無もチェックする。チェック方法などの詳細については「VSDの周術期管理」を参照。
Major Residual Region5)の例
- 心房間・心室間のresidual defect >3mm (※3mm未満(中隔左室側のカラーのjet)であれば血行動態に影響を与えにくいが、3-5mmはmoderate、5mm以上は修復が必要11,13)。Qp/Qs >1.5や右房から肺動脈へのO2 step-up >7%も修復の目安11,13))
- Non-transannular patch
– 肺動脈弁下・弁性・主肺動脈狭窄 peak >3.2m/s(or 圧較差36-40mmHg以上または右室圧/左室圧 >0.66-0.85で有意な残存病変とする6,11))
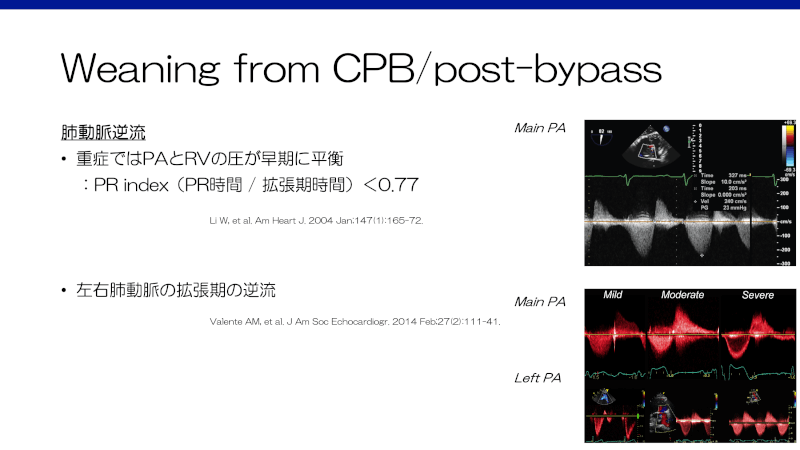
– 中等度以上の肺動脈弁逆流:カラードップラーの逆流jet / RVOT (弁輪径):mild≦1/3、moderate 1/3 – 2/3, severe≧2/312,15,16)、PR index(PR時間 / 拡張期時間)<0.77(重症ではPAとRVの圧が早期に平衡)17)、左右肺動脈の拡張期の逆流18) - Transannular patch:肺動脈弁性狭窄 peak >2.7m/s
- 左右の肺動脈弁狭窄 peak >3.2m/s
- 中等度以上の三尖弁逆流
その他
不整脈:根治術ではVSD閉鎖術も同時に施行されるため、術後は房室ブロックや房室接合部異所性頻拍が発生しうる。
再灌流障害:数ヶ月以上肺血流が減少していた患児の狭窄解除では、再灌流による酸素化低下を認めることがある23)。特に、1歳を超えるまで手術やカテーテルといった介入のない患者で問題となる19)。
たかがファロー、されどファロー
小児心臓に関わる医師の間では、ファロー四徴症を端的に表す言葉として「たかがファロー、されどファロー」というフレーズがある。
近年の手術と周術期管理の進歩により、術当日抜管も可能で術後経過も順調である症例が増えたことから、数ある複雑で予後不良な先天性心疾患と比較し「たかがファロー」と言われることもある。一方、spellによって麻酔導入時に急変する症例や、左心や右心不全により術後の立ち上がりが悪く、エピネプリンも使用しながら数日間の鎮静・人工呼吸管理も必要となるような症例もあることから、「されどファロー」とも言われている。昔から”never trust a tet“とも言われる所以である。
長期予後
手術と周術期管理の向上により、術後の短期的な成績はかなり良く、TOF患者が長期的に生存できるようになった。同時に、多くの患者において長期的な問題点が明らかになった。例えば、肺動脈逆流による右室拡大、肺動脈狭窄、右心室瘤、三尖弁逆流、残存心室中隔欠損などが挙げられる。多くは思春期には問題とならないが、20-30歳代頃より運動能低下や不整脈、心不全兆候が出現する19)。特に肺動脈逆流症は一つのトピックであり、『肺動脈逆流症と肺動脈弁置換術』参照のこと。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- Sandeep et al. J Cardiothorac Surg. 2019 May 2;14(1):84.
- Cullen et al. Circulation. 1995 Mar 15;91(6):1782-9.
- Abdel Aziz et al. J Cardiovasc Ultrasound. 2016 (PMID 27358704).
- Nathan M, et al. J Am Coll Cardiol. 2021 May 18;77(19):2382-2394. PMID: 33985683.
- Kaushal SK, et al. Ann Thorac Surg. 1999 Nov;68(5):1705-12. PMID: 10585046.
- Boni L, et al. Eur J Cardiothorac Surg. 2009 May;35(5):885-9. PMID: 19278860.
- Bacha E, et al. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2012;15(1):24-6. PMID: 22424504.
- Miller JR, et al. J Thorac Cardiovasc Surg. 2023 Jan;165(1):221-250. PMID: 36522807.
- Chaturvedi RR, et al. Circulation. 1999 Oct 5;100(14):1540-7. PMID: 10510058.
- Puri, Goverdhan Dutt et al. Journal of Perioperative Echocardiography, July-December 2014;2(2):51-57.
- Transesophageal Echocardiography for Pediatric and Congenital Heart Disease, 2nd Edition. Pierre C. Wong et al. DOI: https://doi.org/10.1007/978-3-030-57193-1.
- Motta P, et al. Semin Cardiothorac Vasc Anesth. 2012 Jun;16(2):70-87. PMID: 22344815.
- Baumgartner H, et al. J Am Soc Echocardiogr. 2009 Jan;22(1):1-23; quiz 101-2. PMID: 19130998.
- Puchalski MD, et al. Congenit Heart Dis. 2008 May-Jun;3(3):168-75. PMID: 18557879.
- Renella P, et al. J Am Soc Echocardiogr. 2010 Aug;23(8):880-6. PMID: 20591618.
- Li W, et al. Am Heart J. 2004 Jan;147(1):165-72. PMID: 14691436.
- Valente AM, et al. J Am Soc Echocardiogr. 2014 Feb;27(2):111-41. PMID: 24468055.
- Townsley MM, et al. J Cardiothorac Vasc Anesth. 2019 Feb;33(2):556-565. PMID: 29706570.
- Jacobs ML. Ann Thorac Surg. 2000 Apr;69(4 Suppl):S77-82. PMID: 10798419.
- Kirshbom PM, et al. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2004;7:65-71. PMID: 15283354.
- Cornet AD, et al. Crit Care. 2013 Apr 18;17(2):313. PMID: 23635028.
- Yacouby S, et al. J Cardiothorac Vasc Anesth. 2014 Jun;28(3):502-5. PMID: 24485563.
- Baele PL, et al. Anesthesiology. 1991 Jul;75(1):146-9. PMID: 2064041.
- MEINDOK H. Thorax. 1964 Jan;19(1):12-5. PMID: 14105877.
- Bertranou EG, et al. Am J Cardiol. 1978 Sep;42(3):458-66. PMID: 685856.
- Yang X, et al. Postgrad Med J. 2005 Feb;81(952):133-4. PMID: 15701749.
- Attenhofer Jost CH, et al. Mayo Clin Proc. 2010 Dec;85(12):1090-4. PMID: 21123635.
- Dittrich S, et al. Clin Cardiol. 1999 Jul;22(7):460-4. PMID: 10410289.
- Tempe DK, et al. J Cardiothorac Vasc Anesth. 2002 Dec;16(6):752-65. PMID: 12486661.
コメント
コメント一覧 (6件)
[…] 伝導障害は一時的・永久的両方ありうる。心房切開による心房性不整脈や、パッチ縫縮による刺激伝導系の傷害・房室ブロックに注意する。ブロックが発生した場合は、一時的ペーシングワイヤーを留置する。異所性接合部頻拍(Junctional epitopic tachycardia: JET)は1歳未満の患者で多く、特にファロー四徴症のVSD閉鎖術後にみられる1)。 […]
[…] DORVでは、両大血管が完全にもしくは主に右室から起始しており、ほぼ全ての患者がVSDを合併する(この定義によると、DORVは多様な疾患を含み、後述するように形態学的にはファロー四徴症(TOF)や大血管転位(TGA)に似たようなものもある)。 […]
[…] MAPCAのない最も単純なタイプ(PA/VSD)は、いわゆる「ファロー四徴症(TOF)の極型」と考えられる。ここでは、肺血流の起源が大動脈やその枝から分岐した主要体肺側副動脈(Major aortopulmoary collateral arteries: MAPCAs)に由来するタイプについて解説する。 […]
[…] 基本的には小児の心拍出量(Stroke volume × Heart rate)は心拍数に依存することが多いため、ファロー四徴症術後のように心拍数を落とさない管理とすることの方が多い。一方で、Fontan術後は比較的徐脈傾向の方が心拍出量にとっては有利となり、(先天性心疾患患者では徐脈傾向となるため使用に注意の要する)Dexmedetomidineといった薬剤も良い適応となることが多い。 […]
[…] ファロー四徴症(Tetralogy of Fallot: TOF) […]
[…] 今回は、ファロー四徴症(Tetralogy of Fallot: TOF)根治術後の合併症の一つである、肺動脈逆流症と肺動脈弁置換術について、麻酔科医・集中治療医が把握すべき事項を解説します。小児期のTOFと、その姑息術や根治術に関しては、こちらをご覧ください。 […]