麻酔準備に関しては『小児肺移植の適応と麻酔準備』参照。
手術操作
切開・アプローチ法
両側肺移植の場合、胸骨横断切開による前外側開胸(bilateral anterolateral thoracotomies with transverse sternotomy、いわゆる、”clamshell thoracotomy”)、sequentialな両側開胸、胸骨正中切開というアプローチ法が考えられる1)。
- Clamshell:胸骨を横切開し、心肺の視野が確保する。術操作や人工心肺の確立が容易となる。再手術などで癒着が危惧される症例などで好まれる。
- 両側開胸:胸骨の横切開を避けれらるが、逆側の移植のために体位変換が必要となる。人工心肺の確立が複雑。
- 胸骨正中切開:両側の術野を確保できるが、人工心肺が必要となる。癒着により術野が制限される。肥満や乳房により開胸が難しい患者で適応となる。
片側肺移植は、後側方アプローチや前側方アプローチによる開胸が可能である。多くの場合、人工心肺は不要であるが、使用する場合は右前側方開胸であればアクセスしやすい。左側開胸であれば大腿動静脈が選択される。
肺の摘出
血管を剥離・露出後、血管用ステープラーを用いて遠位部で結紮する。気管支周囲のリンパ組織と血管を結紮し、肺葉分岐(secondary carina)のすぐ近位部で気管支を切断する。この際、横隔神経や迷走神経、左反回神経が傷害される可能性があるため注意する1)。両側の場合、片側肺摘出後にグラフトを移植し、次の肺摘出に移る。
グラフトの移植
最初に、気管支の吻合を行う。通常はend-to-endで、膜様部を連続縫合、前方の軟骨部を断続縫合など、様々な方法で吻合される1)。吻合部は肺門部脂肪組織などで覆われ補強される。
次に血管吻合を行うが、その順序は様々である。血管鉗子で肺動脈を遮断後、縫合器によるstaple-lineを切除し、一本の肺動脈同士が吻合される1)。肺静脈の吻合では、肺静脈近位部の左房を鉗子でクランプし、staple-lineを切除する。二つの開口部間に切開を加えることで”left atrial cuff”を作成し、グラフトの肺静脈と吻合する1)。血管内の空気を除去するまで最終的な結紮は行われない。
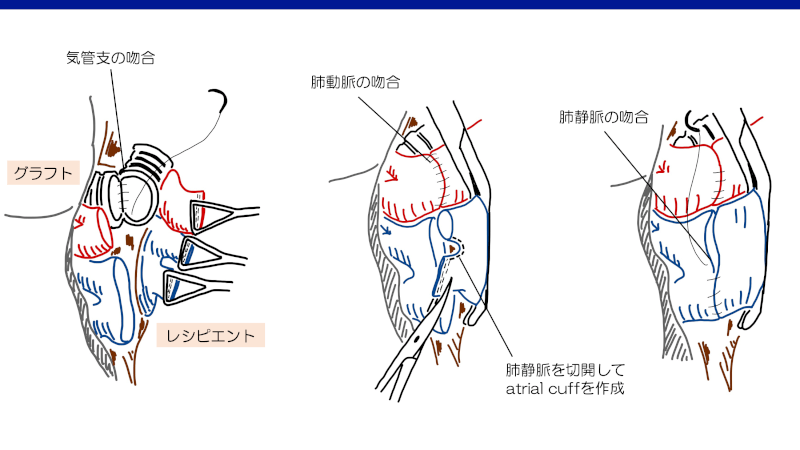
再灌流
左房の縫合を完了する前に、肺動脈の遮断が解除される。縫合線から空気を除去した後、左房の縫合が完了となる。人工心肺を使用しない場合、肺動脈の遮断を部分的に解除することで、ゆっくりと灌流させる。5-10分かけて徐々に灌流することで、急性再灌流を減らせる可能性がある2)。人工心肺を使用している場合、心臓は虚脱し肺血流は最小限となっているため、肺動脈の遮断は完全に解除できる。
Off-pump vs. CPB vs. ECMO
体外循環なし(Off-pump)
レシピエントの肺が片肺換気に耐えられ、肺高血圧のない場合には体外循環を用いず(off-pump)肺移植を行うことが可能である。
- 体外循環のための抗凝固薬は不要であり、出血が少ない。理論的には炎症反応が最小限に抑えられ、予後改善につながる可能性がある3)。
- 心臓の圧迫により血行動態が不安定になりやすく、術野の視野が不良となりやすい。
- 体外循環使用時のような再灌流後の肺血流のコントロールが不能であることから、過灌流により移植肺に傷害が加わる可能性がある。
- 両側肺移植で二つ目の移植の際、一つ目の移植肺の片肺換気が必要となる。
- 肺動脈遮断(clamp test)により血行動態が耐えられない(体血圧低下、肺血圧上昇、頻脈、酸素化低下)場合には不可(体外循環が必要)4)。
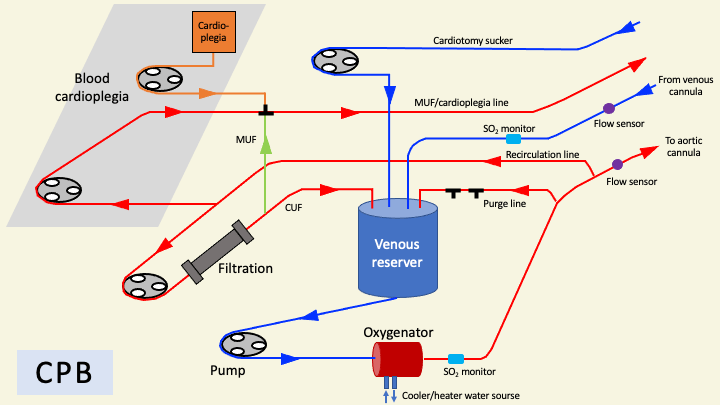
人工心肺(CPB)
肺高血圧症のある患者では、体外循環の使用が推奨される。古くより、肺移植で体外循環が必要な際には人工心肺(CPB)が使用されてきた。CPBの特徴としては、以下が挙げられる。
- 落差(+陰圧吸引補助)脱血により右心系の減圧が容易であり、肺高血圧症や右心不全患者に有用である。
- 静脈槽が存在し血液のリザーバーとして働くため、脱血不良でもしばらく血流量は影響を受けず、血行動態が安定しやすい。大量出血にも対応しやすい(ただし、通常の心臓手術と異なり、気管支を切断による感染のリスクから、術野吸引血は静脈槽へ戻さず破棄される)。
- ガス塞栓の観点においても、脱血側に空気が混入しても送血側に送られることがなく、より安全である。
- 小児などdouble-lumenチューブが入らず片肺換気が不能な患者では、CPBによる脱血で換気を停止させて移植することが可能(ただし、ECMOでもfull flowで換気停止することもある。また、double-lumenチューブが入らずとも、気管支を傷つける危険はあるが気管支をクランプして強制的に片肺換気にすることもある)。
- 開放式回路であり、炎症反応がおきやすい。Primary graft dysfunction (PGD)や肺機能など術後経過に悪影響を及ぼす可能性がある。また、高いレベルの抗凝固が必要となり、周術期輸血量が増える5)。
- 人工心肺を離脱できず術後に体外循環が必要となった場合には、ECMOへのconversionが必要となる。
対外式膜型人工肺(ECMO)
近年、CPBのデメリットから肺移植手術中にECMOを使用する症例が増えている。術中はVA ECMOを使用することが多いが、移植術前にVV ECMOを使用していた患者で血行動態が安定している場合など、VV ECMOを継続することもある6)。ECMOの特徴としては、以下が挙げられる。
- 閉鎖式回路であり、炎症反応が起きにくく、抗凝固の必要量も低い。術後人工呼吸器期間の短縮や病院滞在日数の短縮、輸血量減少が期待できる5,7)。
- 大腿動静脈を用いた場合、術後ECMO使用へのconversionが容易。肺高血圧症の患者では術前の心機能が低下しているため8)、術後のprophylactic ECMOが予後を改善させる可能性がある9)。
- 基本的には心臓の減圧を調整できず、術野確保や吻合部位によっては術操作の邪魔となる。
- リザーバーがなく(小さなリザーバーを追加することは可能)、カニューレの位置変化や術操作による脱血不良が不安定な血行動態や酸素化不良に直結する。特に心臓を圧迫する左側操作で影響を受けやすい10)。
- エアートラップがないため、回路内空気によるガス塞栓の危険が上がる。
- 大腿動静脈を用いたperipheral ECMOでは、左室の後負荷増加や大動脈弁周囲の血流の停滞、”Harlequin syndrome”や”North-South Syndrome”と呼ばれる脳や上半身の不十分な酸素化などが問題となる。

一般的に、重症右心不全、右室の拡張、中等度以上の三尖弁逆流、酸素需要の増加、肺高血圧があれば、ECMOを使用することが多い11)。また、術中にECMOが必要か否かを判断する方法の一つに、クランプテストが挙げられる。例えば、左右の肺動脈を試験的にクランプした際、二酸化炭素分圧の上昇、酸素飽和度の低下(<90%)、心係数の低下(<2L/min/m2)、肺動脈圧の上昇(>体動脈圧)がECMOを要するサインである12)。
一般的なCPBとECMOの比較に関しては、『人工心肺(CPB)と対外式膜型人工肺(ECMO)』も参照。
麻酔
麻酔導入
麻酔導入では、特に循環と呼吸の安定化に注力する。特に肺高血圧症のある患者では、不整脈や肺血管抵抗上昇による右室後負荷の増加、体血圧低下による冠灌流低下を避ける必要がある(『肺高血圧クライシス』参照)。すなわち、酸素化を保ち、二酸化炭素の貯留を避け、肺血管抵抗の上昇を避ける。循環抑制の少ない薬剤であるフェンタニルを主体(10-50μg/kg)とした導入方法があるが、呼吸抑制による二酸化炭素貯留は悪影響を及ぼす。プロポフォールによる急速導入は、血管拡張作用により体血圧低下を引き起こすため、肺高血圧のある患者では致命的となりうる。場合によってはsingle-lumenチューブを挿入し換気を安定化させた後、double-lumenチューブに入れ替えることもありうる。これら一連のプロセスに呼吸と循環が耐えられない可能性があるのであれば、覚醒下で大腿動静脈を用いたperipheral ECMOを導入したのちに麻酔導入する。
麻酔維持と薬剤
肺移植の麻酔方法にガイドラインは存在しないが、麻酔薬と虚血再灌流傷害との関連については幾つか調べられている。セボフルランのプレコンディショニング効果(Anesthetic Preconditioning: APC)は炎症性サイトカインの減少やマクロファージの導入により、心臓をはじめとした臓器の虚血再灌流傷害を抑制することが提唱されている。肺移植においても、動物を用いた基礎実験では、セボフルランによるプレコンディショニングはPrimary Graft Dysfunction (PGD)や急性拒絶(acute rejection: AR)を減らす可能性がある13,14)。しかし、ヒトに関するデータは乏しく、成人・小児に関わらず実施の肺移植の推奨やガイドラインには至っていない。
輸液
ここ数十年、周術期や集中治療領域における輸液バランスと予後悪化との関連を示した研究が多々報告されている。肺移植領域においては、術中輸液の増加とgrade 3のprimary graft dysfunction (PGD)との関連が報告されている15)。また、肺移植周術期における輸血が、PGDや予後不良と関連するとの報告も少なくない16,17,18,19,20)。しかし、輸液や輸血による影響(因果)か否かを判断するのは難しく、出血の結果やその他の交絡因子を介した関連である可能性もある。また、アウトカムとしてのPGDとtransfusion-related lung injury (TRALI)を区別することも容易ではない。周術期の輸血がドナーに対する新規の(de novo)抗HLA抗体(Donor-Specific Antibody: DSA)産生に関連したとの報告21)もあり、不要な輸血は避けるべきである。
換気
閉塞性肺疾患の患者では、肺の過膨張とそれによる静脈環流の低下や肺血管抵抗の上昇に注意する。呼気時間を長くし(I:E ratio=1:3〜4)、呼吸回数を抑える。Auto-PEEPを鑑みPEEPは低めにする。拘束性肺疾患の場合は、一回換気量を少なく呼吸回数を増やし、吸気の時間を維持する。片肺換気はシャントにより酸素化を低下させ、換気量低下により血中二酸化炭素を増加させる。血管作動薬や吸入一酸化窒素で対応できなければ術野で肺動脈を早めにクランプする方法もあるが、右室の後負荷は増加する。呼吸や循環動態が不安定な場合はECMOを開始する。
再灌流後は、一回換気量を6-8 ml/kgで換気を行い、全ての肺葉が換気されていることを確認する。最高気道内圧(Peak Inspiratory Pressure: PIP)を制限し、移植肺の肺外傷を防ぐ。低酸素や肺水腫に対しては高めの呼気終末陽圧(Positive-end expiratory pressure: PEEP)を要することがある。また、移植肺の気管支への灌流は吻合部の感染や離開といった合併症予防に重要であるが、気管支動脈を介する灌流がない状況ではPEEPによって気管支吻合部への灌流が改善する可能性がある22)。例えば、PIP<30 cmH2O、PEEP 6-8 cmH2Oとする23)。再灌流後早期のFiO2を最小限にすることで、虚血再灌流障害とPGDを軽減させる可能性がある19,24)。
経食道心エコー
手術開始前に、心室機能や弁疾患、卵円孔(奇異性塞栓の原因)の有無を評価する。
移植後は、心室機能や血管内容量の評価に加え、肺静脈と肺動脈の評価を行う。
- 右室機能:右室機能は予後と関連する25)。また、肺高血圧による肥大や拡張の影響か、右室流出路狭窄が術早期〜後期に発生しうる26,27)。
- 肺静脈:肺静脈の流速 >1 m/sや肺静脈と左房の圧較差 >10-12 mmHgの時に肺静脈狭窄を疑う。肺静脈の流速 >1.6m/sであればグラフト不全と強く関連するため介入を要する28)。
- 肺動脈:ドナー側の肺動脈がレシピエント側の肺動脈の75%以上あるべきである29)。
References
- Nguyen DC, et al. J Thorac Dis. 2019 Sep;11(Suppl 14):S1810-S1816. PMID: 31632758.
- Pierre AF, et al. J Thorac Cardiovasc Surg. 1998 Dec;116(6):932-42. PMID: 9832683.
- Ohsumi A, et al. Gen Thorac Cardiovasc Surg. 2021 Apr;69(4):631-637. PMID: 33666866.
- Ruszel N, et al. J Cardiothorac Surg. 2021 Nov 27;16(1):341. PMID: 34838067.
- Magouliotis DE, et al. Gen Thorac Cardiovasc Surg. 2018 Jan;66(1):38-47. PMID: 28918471.
- Hashimoto K, et al. J Heart Lung Transplant. 2018 Dec;37(12):1418-1424. PMID: 30193763.
- Hoechter DJ, et al. ASAIO J. 2017 Sep/Oct;63(5):551-561. PMID: 28257296.
- Kasimir MT, et al. Eur J Cardiothorac Surg. 2004 Oct;26(4):776-81. PMID: 15450572.
- Moser B, et al. Eur J Cardiothorac Surg. 2018 Jan 1;53(1):178-185. PMID: 28950326.
- Moreno Garijo J, et al. J Cardiothorac Vasc Anesth. 2019 Jul;33(7):1995-2006. PMID: 30455142.
- Shah PR, et al. J Cardiothorac Vasc Anesth. 2017 Apr;31(2):418-425. PMID: 27842947.
- Ius F, et al. J Heart Lung Transplant. 2016 Jan;35(1):49-58. PMID: 26496786.
- Yamada Y, et al. J Surg Res. 2017 Jun 15;214:270-277. PMID: 28624055.
- Casanova J, et al. Anesth Analg. 2011 Oct;113(4):742-8. PMID: 21890883.
- Geube MA, et al. Anesth Analg. 2016 Apr;122(4):1081-8. PMID: 26991618.
- Hayes D Jr, et al. Clin Transplant. 2016 Dec;30(12):1545-1551. PMID: 27653312.
- Ong LP, et al. Ann Thorac Surg. 2016 Feb;101(2):512-9. PMID: 26453422.
- Cernak V, et al. J Cardiothorac Vasc Anesth. 2019 Sep;33(9):2478-2486. PMID: 31147209.
- Diamond JM, et al. Am J Respir Crit Care Med. 2013 Mar 1;187(5):527-34. PMID: 23306540.
- Liu Y, et al. PLoS One. 2014 Mar 21;9(3):e92773. PMID: 24658073.
- Stoker A, et al. J Cardiothorac Vasc Anesth. 2023 Sep;37(9):1609-1617. PMID: 37263806.
- Yokomise H, et al. J Thorac Cardiovasc Surg. 1991 Feb;101(2):201-8. PMID: 1825125.
- Barnes L, et al. Curr Pulmonol Rep. 2015 Jun;4(2):88-96. PMID: 26495241.
- Grace PA. Br J Surg. 1994 May;81(5):637-47. PMID: 8044536.
- Kusunose K, et al. JACC Cardiovasc Imaging. 2014 Nov;7(11):1084-94. PMID: 25459589.
- Chen F, et al. Thorac Cardiovasc Surg. 2009 Feb;57(1):48-50. PMID: 19169998.
- Kirshbom PM, et al. Chest. 1996 Feb;109(2):575-7. PMID: 8620744.
- Murray AW, et al. J Thorac Dis. 2021 Nov;13(11):6550-6563. PMID: 34992834.
- Tan Z, et al. J Cardiothorac Vasc Anesth. 2019 Jun;33(6):1548-1558. PMID: 30709594.


コメント