以下、人工心肺中の管理について、麻酔科医・集中治療医が把握すべき事項を解説します。
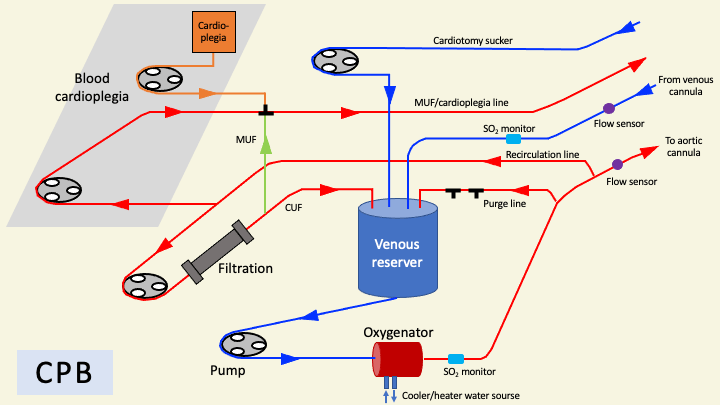
回路
ポンプ(ローラー型と遠心型)・人工肺については、『人工心肺(CPB)と体外式膜型人工肺(ECMO』を参照。
プライミングと希釈
ヘマトクリット
成人回路の充填量は1000ml程度であるため、希釈率は20%程度で済む。しかし、小児人工心肺の最小充填量が約230mlである2)ため、例えば3kgの患児の循環血液量が255ml(85ml/kg)とすると、その希釈率は40-50%となる。回路の長さを制限し、チューブ経を小さくすることで、最小充填量を減らすことが可能(ex. 100-150ml2))である。しかし、脱血の吸引補助による微小ガス塞栓の危険が増加する7)ため、最小充填量は施設によって異なる。日本では、7-8kg未満の患児に対して有血充填を行なっている施設が多い2)。
| 体重(kg) | 循環血液量(ml/kg) |
| <3 | 90 |
| 3-10 | 85 |
| 10-20 | 80 |
| 20-30 | 75 |
| 30-50 | 70 |
| >50 | 65 |
歴史的には小児に対する輸血を減らすため,人工心肺中は血液を希釈し管理されてきた。しかし、過度な血液希釈と神経学的予後悪化との関連を示したランダム化比較試験3)が発表されて以来,人工心肺中の最適なヘマトクリット値については未だ議論中である。これまでの研究からはヘマトクリット値25%以上を維持することが推奨される4,5)が、年齢(ex. 新生児はHt 30-35%)やチアノーゼ(ex. チアノーゼ性疾患ではHt 30%以上)による調整が必要かもしれない1)。また、灌流圧や血液流量、体温管理によっても目標値が異なる可能性がある。
プライミング量の一例
– 7kg未満:350ml (人工心肺185ml、血液濃縮回路70ml、リザーバーレベル約100ml)
– 7-15kg:450ml
– 15-25kg:600ml
膠質浸透圧と凝固因子
患者の体重が小さければ小さいほど、より多くの血液製剤がプライミングに必要となる。膠質浸透圧を維持し最小限の凝固因子を確保するため、アルブミンやFFPが追加される。FFPを使用することで、複雑心奇形やチアノーゼ症例における術中輸血量を減らすことができる6)が、人工心肺終了時の高フィブリノゲン濃度や良好な血液弾性粘稠度検査(トロンボエラストグラフ)にも関わらず術後輸血量は変わらない8)といった報告もある。
灌流圧と血液流量
新生児では、血管反応性の低下や動脈管などのシャントの存在により、灌流圧が低くなりやすい。灌流圧(平均血圧−中心静脈圧)の目標は,新生児で30-40 mmHg、2歳以降では40-50 mmHgが一つの目安である1)。
人工心肺中の血流量は体重や体表面積を元に計算されることが多いが、代謝率の高い新生児や動脈管などの循環回路内のシャント、側副血行路の存在によっては高血液流量が必要となる。また、個々の症例によって流量を調節する。例えば,10kgまでは150 mL/kg/min(10kg以上は2.4 L/min/m2)を基準とし、低体温による代謝抑制下では80-100 mL/kg/min,複雑な心内修復では術野の視野確保のため超低体温下で25-50 mL/kg/minまで流量を低下させることもある1)。体表面積を元に流量を調節する場合は,新生児では2.6-3.2 L/min/m2、乳児で2.4-2.6 L/min/m2が推奨される1)。最近では、人工心肺中の酸素需要を考慮した、Goal-directed perfusion (GDP)という考え方が提唱されて、臓器保護という観点で注目されている。
小児では大静脈が細く、脱血側の評価も重要である。患者の頭部や顔面の所見は重要で、静脈閉塞の兆候として頭皮や顔面の発赤腫脹やチアノーゼ、頭部酸素飽和度の低下などが挙げられる。上大静脈に留置されている場合の中心静脈圧は低く(<5 mmHg)あるべきで、位置が脱血管に隣接していればしばしば陰圧となる1)。
体温
低体温と臓器保護
肺血流が減少している慢性的なチアノーゼ疾患では体肺側副血行路(Aortopulmonary collaterals)が発達し、血液還流により術野が視野不良となりやすい。人工心肺の血液流量を減らして対応することがあるが、酸素供給量低下に対し低体温にすることで代謝率が減少し、心筋保護10)や神経保護11)に働く可能性があり、人工心肺中の管理として普及した。小児心臓手術では、28-32℃程度の低体温や18℃の超低体温循環停止(Deep Hypothermic Circulatory Arrest: DHCA)は稀ではない。低血液流量や循環停止を要するような複雑な手術で、より低い体温管理が求められる。
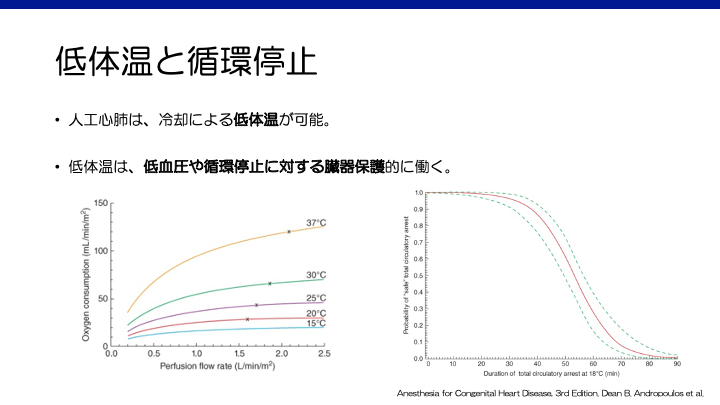
冷却と復温
速すぎる冷却が神経学的機能に悪影響を及ぼす可能性があり、超低体温循環停止を用いる場合は最低でも20分かけて冷却(1℃/minを上回らない速さ)する1,12)。また、速すぎる復温も問題であり、加温により行き過ぎた高体温が起こりうる。復温時の過度な加温は微小バブル形成の危険があり、虚血後の高体温は後期の神経細胞壊死を引き起こす13)。復温は0.5℃/minを上回らない速さとし、復温後は高体温を避けることが周術期に重要である14,15,16)。離脱時の目標値としては、咽頭温>35.0℃、膀胱温>36.2℃、皮膚温>30℃、直腸温>35.5℃といった指標が提唱されている1)。
低体温の欠点
低体温には臓器保護という利点があるが、止血機能低下や術後出血傾向17)、微小循環不全と毛細血管漏出18)、脳の自己調節能の障害19)、グルコース代謝障害20)、心筋収縮力低下21)といった悪影響が報告されている。また、低体温を使用することで人工心肺時間は延長し、低体温後の過剰な復温は上述の通り神経学的傷害を引き起こす。それゆえ、成人心臓手術では正常体温下人工心肺が用いられてきており、小児においても広まりつつある22,23)。
超低体温循環停止
超低体温循環停止(Deep hypothermic circulatory arrest: DHCA)では、患者の体温を17-18℃にまで冷却し、人工心肺のポンプを止める。術野が完全に無血となるメリットから普及し、新生児や小さな患児で複雑な心内・大動脈修復術が可能となった。しかし、長時間のDHCAは神経学的予後悪化と関連する。
1988年から1992年に大動脈スイッチ術を施行された新生児を対象としたBoston Circulatory Arrest Studyなどを基に、先天性心疾患における許容DHCA時間のカットオフとして41分という数字24)が用いられてきたが、神経学的予後改善目的にDHCAを15-30分に分割し、1-2分の再灌流を挟む方法(intermittent perfusion)なども提唱されている1,25)。
血液ガス
低体温と血液ガス
臓器保護を目的として、特に脳の代謝と酸素消費を抑えるため、上述のように人工心肺中に低体温が用いられることがある。低体温下では、二酸化炭素はより血液中に溶存し易くなり、その分圧は減少する。すなわち、体温が下がるに従いPaCO2は低下し、pHとPaCO2が補正されなければ深部温17-18℃ではpH 7.6, PaCO2 15-19 mmHgとなる1)。
α-stat管理とpH-stat管理
これに対し、特に補正せず管理する方法がα-stat管理である。通常の血液ガス分析装置では検体を37℃に加温して測定するため、血液ガス分析装置の結果は正常(pH 7.4、PaCO2 40mmHg)となる。極端に低いPaCO2は、脳血管収縮と脳血流低下を引き起こし、脳の冷却が非効率的になり、脳保護効果が減弱する26)可能性がある。
一方pH-statでは、低体温下においてもpH 7.4、PaCO2 40 mmHgとなるように補正して管理する。二酸化炭素を貯留させることで脳冷却や再灌流の効率が増し、脳血流増加による冷却や復温が素早くなることで脳保護的に作用する可能性がある27,28)。また、pHの変化を予防し低体温による酸素ヘモグロビン解離曲線の左方シフトを防ぐことで、ヘモグロビン親和性が低下し酸素運搬が改善する29)といった利点も考えられる。
管理法と予後への影響
1996年に発表された成人を対象としたランダム化比較試験で、人工心肺使用後の神経学的合併症はpH-statで多いことが示され30)、α-statが成人と小児の両方で用いられてきた。しかし、動物のこどもでpH-statにおける神経学的予後の優位性が報告され31,32)、小児領域において注目が集まった。小児を対象とした臨床研究においても、pH-statで脳組織酸素飽和度の改善33)、脳電気的活動の早期回復34)、神経発達予後改善35)を示した報告や、alpha-statとpH-statの間で神経発達に関して一貫した改善や悪化効果はないとの報告36)もある。神経発達予後以外に関しても、pH-statによる心筋保護の可能性、人工呼吸期間の短縮、ICU滞在日数の短縮が報告されている37)。
成人ではpH-statにより脳血流が増え脳塞栓が増える可能性や、小児では神経学的傷害の主要な原因は低酸素性虚血であり38)pH-statで脳血流を増加させることは優位に働く可能性が提唱されている1)が、議論の余地があり31)、詳細はまだ明らかでない。
上記を踏まえ、小児心臓手術ではpH-statがDHCA中の脳や全身保護にとって優位に働く可能性があり、pH-statを採用している施設も多い。少なくとも冷却中は、脳組織酸素負荷を改善し脳神経保護のためにpH-stat管理を用いるべきといった意見もある26,32)。日本では、約半数の施設がα-stat、3割がpH-stat、2割が両方(ex. 冷却と復温時で使い分ける)を採用している2)。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- 吉田譲, 岩城秀平, 古山義明ほか. 小児体外循環国内アンケート結果報告. 体外循環技術 2017 ; 44(1) : 54-58.
- Jonas RA, et al. J Thorac Cardiovasc Surg. 2003 Dec;126(6):1765-74. PMID: 14688685.
- Newburger JW, et al. J Thorac Cardiovasc Surg. 2008 Feb;135(2):347-54, 354.e1-4. PMID: 18242267.
- Wypij D, et al. J Thorac Cardiovasc Surg. 2008 Feb;135(2):355-60. PMID: 18242268.
- Oliver WC Jr, et al. Ann Thorac Surg. 2003 May;75(5):1506-12. PMID: 12735570.
- Davila RM, et al. Ann Thorac Surg. 2001 Apr;71(4):1369-71. PMID: 11308201.
- Lee JW, et al. Yonsei Med J. 2013 May 1;54(3):752-62. PMID: 23549826.
- Mosteller RD. N Engl J Med. 1987 Oct 22;317(17):1098. PMID: 3657876.
- Kuniyoshi Y, et al. Ann Thorac Cardiovasc Surg. 2003 Jun;9(3):155-62. PMID: 12875636.
- Croughwell N, et al. J Thorac Cardiovasc Surg. 1992 Mar;103(3):549-54. PMID: 1545554.
- Bellinger DC, et al. Pediatrics. 1991 May;87(5):701-7. PMID: 2020517.
- Chopp M, et al. Stroke. 1991 Jan;22(1):37-43. PMID: 1987671.
- Shum-Tim D, et al. J Thorac Cardiovasc Surg. 1998 Nov;116(5):780-92. PMID: 9806385.
- Grigore AM, et al. Anesth Analg. 2009 Dec;109(6):1741-51. PMID: 19923500.
- Engelman R, et al. J Extra Corpor Technol. 2015 Sep;47(3):145-54. PMID: 26543248.
- Boldt J, et al. Ann Thorac Surg. 1996 Jul;62(1):130-5. PMID: 8678631.
- Yamada S. Kurume Med J. 2004;51(1):1-7. PMID: 15150894.
- Hillier SC, et al. Anesth Analg. 1991 Jun;72(6):723-8. PMID: 2035855.
- Pigula FA, et al. J Thorac Cardiovasc Surg. 2001 Feb;121(2):366-73. PMID: 11174743.
- Lewis ME, et al. J Am Coll Cardiol. 2002 Jan 2;39(1):102-8. PMID: 11755294.
- Caputo M, et al. Ann Thorac Surg. 2005 Sep;80(3):982-8. PMID: 16122470.
- Rasmussen LS, et al. J Cardiothorac Vasc Anesth. 2001 Oct;15(5):563-6. PMID: 11687995.
- Wypij D, et al. J Thorac Cardiovasc Surg. 2003 Nov;126(5):1397-403. PMID: 14666011.
- Langley SM, et al. Ann Thorac Surg. 1999 Jul;68(1):4-12; discussion 12-3. PMID: 10421107.
- Kurth CD, et al. Anesthesiology. 1998 Jul;89(1):110-8. PMID: 9667301.
- Aoki M, et al. Ann Thorac Surg. 1993 May;55(5):1093-103. PMID: 8494416.
- Hiramatsu T, et al. J Thorac Cardiovasc Surg. 1995 May;109(5):948-57; discussion 957-8. PMID: 7739257.
- CALLAGHAN PB, et al. Ann Surg. 1961 Dec;154(6):903-10. PMID: 13875762.
- Patel RL, et al. J Thorac Cardiovasc Surg. 1996 Jun;111(6):1267-79. PMID: 8642829.
- Dahlbacka S, et al. Ann Thorac Surg. 2005 Apr;79(4):1316-25. PMID: 15797070.
- Priestley MA, et al. J Thorac Cardiovasc Surg. 2001 Feb;121(2):336-43. PMID: 11174740.
- Sakamoto T, et al. J Thorac Cardiovasc Surg. 2004 Jan;127(1):12-9. PMID: 14752407.
- du Plessis AJ, et al. J Thorac Cardiovasc Surg. 1997 Dec;114(6):991-1000; discussion 1000-1. PMID: 9434694.
- Jonas RA, et al. J Thorac Cardiovasc Surg. 1993 Aug;106(2):362-8. PMID: 8341077.
- Bellinger DC, et al. J Thorac Cardiovasc Surg. 2001 Feb;121(2):374-83. PMID: 11174744.
- Nagy ZL, et al. Circulation. 2003 Aug 5;108(5):577-82. PMID: 12874184.
- Scallan MJ. Paediatr Anaesth. 2003 May;13(4):284-93. PMID: 12753440.
コメント