以下、小児の大動脈弁狭窄症(Aortic valve stenosis: AS)の周術期管理について、麻酔科医・集中治療医が把握すべき事項について解説します。
解剖・分類
正常な大動脈弁は3つの弁尖から構成されるが、弁性狭窄では二尖弁や一尖弁のこともあり、交連部はしばしば部分的に癒着している1)。弁性狭窄では胎生期に前方への血流が低下するため、十分に構造が発達できず、大動脈縮窄症や上行大動脈低形成と関連する1)。
病態生理
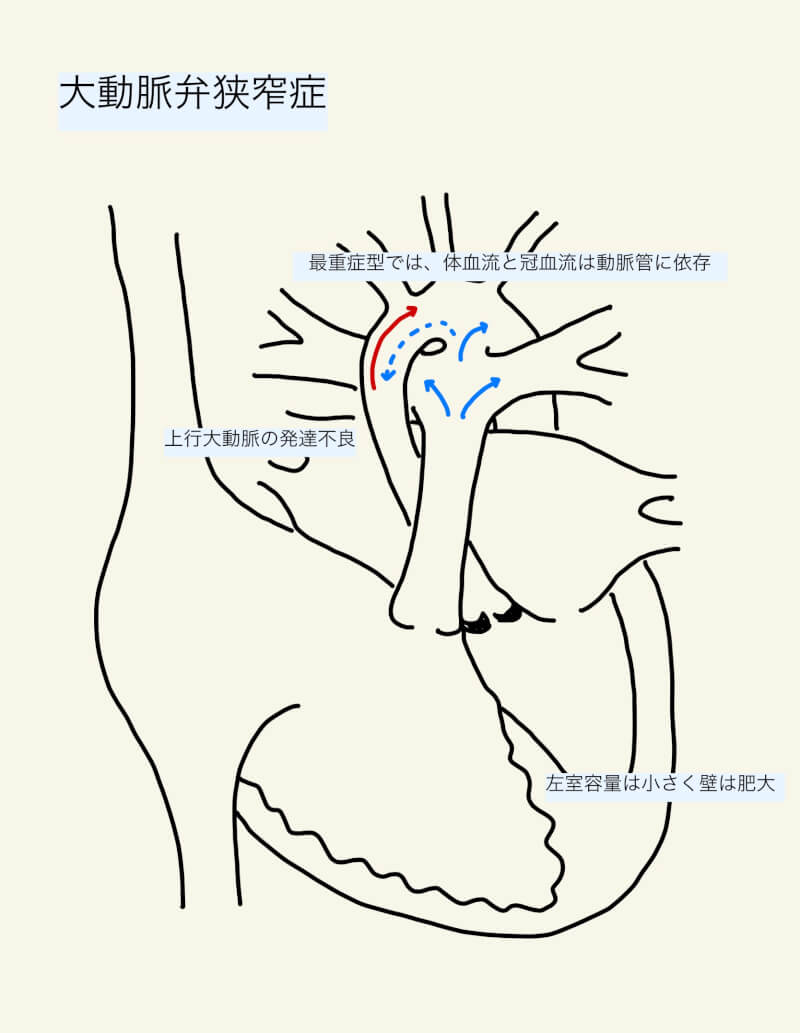
多くの患者は小児期・思春期には無症状である。軽症から中等症では、正常な心室壁張力が心筋肥大により維持されるため、左室一回心拍出量はある程度維持される。しかし、左室内圧の上昇により心内膜下灌流が障害され、心筋虚血が起こりうる。相対的心内膜下虚血が続くと左室の収縮機能は低下する。
一方で重症ASでは、生後一週目で症状を呈する1)。最重症型では、体血流と冠灌流は動脈管を介した逆行性血流に依存することがある。この場合、新生児期に動脈管が自然閉鎖した後に肺うっ血や代謝性アシドーシス、僧帽弁閉鎖不全を呈し、急速に心原性ショックへ進行する。
方針
軽症のASでは保存的に観察され、修復や弁置換が施行された場合でもその予後は良い2)。
重症ASの新生児は緊急の介入が必要である。患者の年齢、大動脈弁の大きさ、三尖弁逆流の存在、大動脈基部径(ROOT)、左室長軸/心長軸(LAR)、体表面積(BSA)、僧帽弁口面積(MVA)に基づいて、単心室循環か二心室修復を目指すかを判断する3,4)。
例:Rhodes’ Score3)
=14.0(BSA)+0.943(ROOT)+4.78(LAR)+0.157(MVA)-12.03
- 特に、LAR <=0.8, ROOT <=3.5 cm/m2, MVA <=4.75cm2/m2は、危険因子。
- Rhodes’ Score > -0.35なら二心室修復での生存率が約90%。
すなわち、高リスク患者では二心室修復の予後が悪く、単心室循環を見据えた方針とする。
単心室循環
Norwood手術→Glenn手術→Fontan手術を参考のこと。
二心室修復
経皮的バルーン弁形成術
十分な左室サイズがあれば、重症の動脈管依存性先天性ASの多くで、経皮的バルーン弁形成術が第一選択となる1)。バルーンを大腿動脈、臍動脈、頸動脈から逆行性にバルーンを進めていく方法と、大腿静脈や臍静脈より挿入し、卵円孔から左房・左室へ進める方法がある1)。
外科的手術
重症ASに対し、始めから外科的弁切開術を選択することもある。利点としては、弁を直接観察し交連切開が可能であることと、動脈管、心室中隔欠損、大動脈縮窄症のような併存心病変を同時に修復できることである。
近年、自己肺動脈を用いて大動脈弁を置換し、切除した右室流出路をホモグラフトで再建する、Ross手術という術式が増えている1)。左右の冠動脈は吻合した主肺動脈に吻合する。Konno手術は、大動脈基部と心室中隔の切開しパッチで閉鎖することで弁輪を拡大し、狭窄予防のため右室流出路をパッチで覆うように再建する方法である1)。Ross手術とKonno手術を組み合わせたRoss-Konnoという術式もある。
また、心室中隔欠損のある患者で、左室機能やサイズに問題のない場合は、左室から(baffleを用いて)心室中隔欠損を介して肺動脈へ流出路を形成し、DKS吻合で大動脈と肺動脈と合わせて新大動脈を作成することで全身血流とし、肺血流をRV-PA conduit (Rastelli)でまかなうYasui手術という方法もある。
最近では、自己心膜を用いた大動脈弁再建術(Ozaki手術)9)が、成人だけでなく小児に対しても報告されるようになってきた。
弁置換術
小児では抗凝固療法のコントロールが難しく、組織増生による弁機能不全、成長による相対的狭窄のため再弁置換術が必要となるといった問題点があるため、弁置換術は成長の大半が終了した思春期以降が適応となる1)。
| 新生児・乳児 | 小児 | |
| 弁修復 | 早期死亡率:3-4% 10年生存率:94% 10年手術回避率:66% | 早期死亡率:0.1-1.8% 10年生存率:94% 10年手術回避率:70% |
| Ross手術 | 早期死亡率:10-17% 10年生存率:79% 10年手術回避率:62% | 早期死亡率:0-4% 10年生存率:96% 10年手術回避率:90% |
| Ozaki手術 | 報告なし | 早期死亡率:0% 10年生存率:報告なし 3年手術回避率:80% |
| 弁置換術(機械弁) | 不適 | 早期死亡率:0.5-7% 10年生存率:82% 10年手術回避率:78% |
| 弁置換術(ホモグラフト) | 報告なし | 早期死亡率:5-13% 10年生存率:85% 10年手術回避率:50-60% |
術前チェック項目
心エコー・心臓カテーテル検査では
- 大動脈弁:弁の形態(弁尖数や弁尖の肥厚の有無)、弁輪径、狭窄部の圧較差(※左室機能低下は圧較差を過小評価し、心室内左右シャントは弁口面積を過小評価するので注意。)
- 左室駆出率:長期にわたる心室壁張力上昇・壁肥厚では、相対的虚血で収縮力低下
- 左室拡張末期容量:左室は小さい。長期の収縮機能低下で心室は拡張。
- 大動脈基部径:二心室修復適応の判断基準
- 僧帽弁口面積:二心室修復適応の判断基準
- 上行大動脈:重症では低形成
- 大動脈縮窄症、動脈管や心室中隔欠損といった合併心奇形
を評価する。
注意すべきは、大動脈圧と左室圧のピークには時間差(大動脈圧は収縮後期に、左室圧は収縮中期にピーク)があり、カテーテル検査によるpeak-to-peakの圧較差(大動脈圧最大値と左室圧最大値の差)は同時圧較差(instantaneous pressure gradient)を過小評価してしまうことである。一方、連続波ドップラーによる最大・平均圧較差は、同時圧較差をよく反映する5)。ちなみに、連続波ドップラーによる平均圧較差は、カテーテル検査による(平均ではなく)peak-to-peakの圧較差に近い5)。
- 左心系流出路狭窄の有無を分ける臨床的なラインは20mmHg(cf. 右心系は30mmHg)。
- 最大同時圧較差<= 30mmHg:内科的治療を選択7)。
- 最大同時圧較差 30-50mmHg (約3m/sec):介入適応は症状や病態次第7)。
- 最大同時圧較差> 50mmHgは:治療介入の適応7)。
- ドップラーによる最大同時圧較差の最大値 >65 (約4m/sec)-75 mmHg、peak-to-peak圧較差 >50-60 mmHgは重症であり、生後1週間内に症状を呈する1)、または心室性不整脈や突然死のリスクあり。
ACC/AHAのガイドライン10)は、成人を対象としているが、小児に対しても参考になる11)。
- Mild: peak velocity < 3 m/s, mean gradient <20 mmHg, valve area > 1.5 cm2
- Moderate: peak velocity 3.0–3.9 m/s, mean gradient 20–39 mmHg, valve area 1.0–1.5 cm2
- Severe: peak velocity > 4 m/s, mean gradient >40 mmHg, valve area < 1.0 cm2
周術期管理
術前・術中管理
麻酔管理の目標は、前負荷、後負荷、心収縮力の維持し、肥大左室心筋の増加した酸素需要を満たし心拍出量を最適化することである。一般的に正常かやや低めの心拍数が好まれるが、新生児では一回拍出量が一定であり心拍出量は心拍数依存性であるため、徐脈は逆効果となる可能性がある。
体血管抵抗低下や頻脈には注意すべきで、心筋虚血や患者状態の急激な悪化を招く可能性がある。心臓カテーテル中の不整脈を契機に循環動態が急激に悪化することがあり、積極的に治療すべきである。
経皮的バルーン弁形成術の際は、アデノシンやエスモロール、220-240/minの右室オーバードライブペーシングにより、バルーンによる左室流出路閉塞やバルーン排出による弁の損傷を防ぐ1)。
人工心肺離脱後
経食道心エコーでは、
- 大動脈弁の残存圧較差
- 心筋壁運動異常:Ross手術では冠動脈移植を伴う
- 右室流出路狭窄:Ross-Konno手術でパッチが邪魔することがある
を評価する。
術後管理
弁形成術や弁置換術では、人工心肺・大動脈遮断による心筋虚血、低心拍出量症候群、出血といった一般的な合併症に注意を払う。Ross手術やRoss-Konno手術は複雑で長時間の大動脈遮断となるため、心機能への悪影響は強い。
Ross手術では冠動脈移植を伴うため、虚血性変化のモニターとして心電図変化に注意する。
Ross-Konno手術では右室流出路狭窄や、心室中隔の切開による不整脈・心機能低下が問題となる。新大動脈弁と右室流出路の両方に狭窄や逆流などの問題点が起こりうる。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- Khan MS et al. J Thorac Cardiovasc Surg. 2013 Sep;146(3):512-20.
- Rhodes LA et al. Circulation. 1991 Dec;84(6):2325-35.
- Lofland GK et al. J Thorac Cardiovasc Surg. 2001 Jan;121(1):10-27.
- Currie PJ et al. J Am Coll Cardiol. 1986 Apr;7(4):800-6.
- Corno AF. Eur J Cardiothorac Surg. 2005 Jan;27(1):67-73. PMID: 15621473.
- Etnel JR et al. Eur J Cardiothorac Surg. 2015 Aug;48(2):212-20. PMID: 25378361.
- Buratto E et al. J Thorac Cardiovasc Surg. 2020 Aug 3:S0022-5223(20)32235-2. PMID: 32891449.
- Ozaki S, et al. J Thorac Cardiovasc Surg. 2018 Jun;155(6):2379-2387. PMID: 29567131.
- Nishimura RA, et al. J Am Coll Cardiol. 2014 Jun 10;63(22):e57-185. PMID: 24603191.
- Transesophageal Echocardiography for Pediatric and Congenital Heart Disease, 2nd Edition. Pierre C. Wong et al. DOI: https://doi.org/10.1007/978-3-030-57193-1.
コメント
コメント一覧 (4件)
[…] 心房中隔欠損症(Atrial septal defects: ASD) […]
[…] 術式としては、パッチを用いた動脈形成術、端々吻合を用いた狭窄輪の切開、またはRoss/Ross-Konno手術などがある。冠動脈入口部の狭窄や肺動脈狭窄症を合併している場合は、それぞれに対して治療を行う1)。 […]
[…] 狭窄部位によっては、Konno手術や人工弁置換、Ross-Konno手術が行われる1)。 […]
[…] 大動脈縮窄症(±大動脈弓低形成・)では、左室が小さく二心室と単心室の境界である”borderline left ventricle (borderline LV)“をきたす。大動脈弁狭窄症におけるborderline LVとの違いは、左室の成長である。 […]