以下、完全大血管転位の周術期管理に際し、麻酔科医・集中治療医が把握すべき事項を解説します。
解剖・分類
完全大血管転位(uncorrected TGA)は、d-TGAとも呼ばれる。右房と右室、左房と左室の関係は正常(AV concordance)であるが、心室と動脈に不一致(VA discordance)を認める。大動脈は右室から、肺動脈は左室から起始する。正常では大動脈は肺動脈幹の右側後方に位置するが、d-TGAでは大動脈は肺動脈幹の右側前方に位置する。
臨床的に重要なのは以下のタイプ1)。
- TGA/IVS(I型)
- TGA+VSD (Taussing-Bing形成異常を含む)(II型)
- TGA+VSD+LVOTO(III型)
※稀ではあるが、TGA/IVSにLVOTOが合併するタイプも存在する。
Taussing-Bing heart (TBH)は、DORVの複雑型であり、心室動脈結合は「double outlet」であるため厳密にはTGAではないが、解剖・生理学・管理的観点からは非常に似ているためTGAの病態生理学として含まれる1)。漏斗部中隔の肥大により大動脈弁下(右室流出路)が狭窄しやすく、大動脈縮窄・離断を合併しやすい。
病態整理
TGAでは、心房心室結合一致のため右房から右室へ、左房から左室へ血液が流れるが、心室動脈結合不一致により右室から大動脈、左室から肺動脈に流れるため、肺循環と体循環が平行に存在する。
平行循環の血液の混合(mixing)が生存には必須であり、その量が酸素飽和度と臨床症状の重症度に大きな影響を及ぼす。心内混合部位としては、心房レベル(ASD、PFO)や心室レベル(VSD)があり、心外混合部位としては、動脈管を介した大動脈レベルがある。
混合の効率という点では、心房中隔レベルが最も効果的である1)。なぜなら、左心房圧は常に右心房圧よりも高いため、周期を通して左右シャントが発生し、酸素化された肺静脈血は酸素化の低い体静脈へ流れる。一方で、動脈管やVSDを介したシャントは、酸素化されていない血液のシャント(大動脈→肺動脈、右室→左室)が多く、心房間ほど効率的ではない。これが、チアノーゼ性のd-TGA患者でBASが行われる理由である1)。
混合の効率は、更に肺血流量によって影響を受ける。例えば、肺動脈弁下狭窄や肺血管閉塞性病変がある場合は肺血流が減少し、混合が減る。心拍出量減少(低容量、揮発性麻酔薬による心筋収縮力抑制)によっても肺血流が減少し、チアノーゼが増悪する1)。
一般的には、十分な血液の混合がない場合にはチアノーゼが著明となり、大量の血液混合があり肺血流が増加した場合はうっ血性心不全を呈する1)。
TGA/IVS(I型)
循環間混合の程度は心房間交通と動脈管の開存性に依存する。
動脈管なし

心房間交通が不十分である場合は、動静脈血の混合が少なく、チアノーゼが著明となる。肺静脈血は右房にあまり流れず、肺血流量が増加、肺うっ血となる。そのため、生後1日目に重度のチアノーゼを呈し、アシドーシスや循環虚脱となる。
心房間交通が十分である場合は、心房間で動静脈血液が混合され、チアノーゼは軽度である。左房は心房間交通により減圧されるため左房圧は上昇せず、肺うっ血は軽度である。
動脈管あり
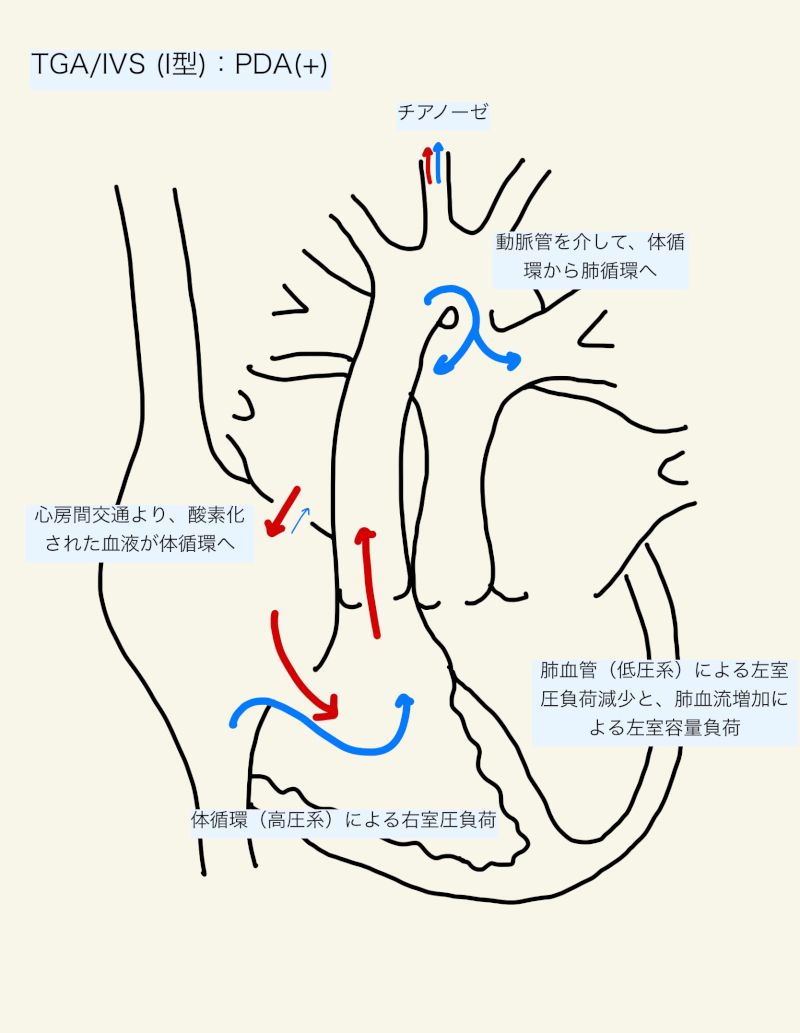
(プロスタグランジンの投与などで)動脈管が開存し、心房間交通が十分の場合、大動脈から動脈管を介して肺動脈へ、左房から心房中隔を介して右房へ血液がシャントし、mixingが高まり酸素化は改善する。しかし、動脈管(と心房中隔)を介したシャントは過剰な循環となり、volume overloadからうっ血性心不全の危険を高める。
心房間交通が小さい場合、動脈管だけでは十分なmixingとならないことが多い。動脈管により増加した肺血流は右房にあまり流れず、左房圧上昇と肺うっ血となる。
※肺血管抵抗が高く肺動脈圧が大動脈圧よりも高い時は、動脈管を介した血液は肺動脈から大動脈へ流れる。この状況では、管前の動脈酸素飽和度(右上肢)は管後の動脈酸素飽和度(下肢)よりも低くなる。これを、右手の酸素飽和度が下肢よりも高くなる”differential cyanosis”と対比し、”Reversed differential cyanosis“と呼ぶこともある14))。
Differential cyanosis14)
- Differential cyanosis: 右上肢よりも下肢の酸素飽和度が低くなる、一般的なタイプ。肺動脈から下行大動脈へ動脈管を介して血液が流れることによる。肺高血圧症、管前性の大動脈縮窄症や大動脈離断症など。
- Reversed differential cyanosis: 下肢よりも右上肢の酸素飽和度が低くなる。酸素化された血液が動脈管を介して下行大動脈へ流れる。完全大血管転位の肺高血圧症、完全大血管転位の管前性大動脈縮窄症や大動脈離断症など。総肺静脈還流異常症の報告も。
TGA/VSD ±左室流出路狭窄(II, III型)
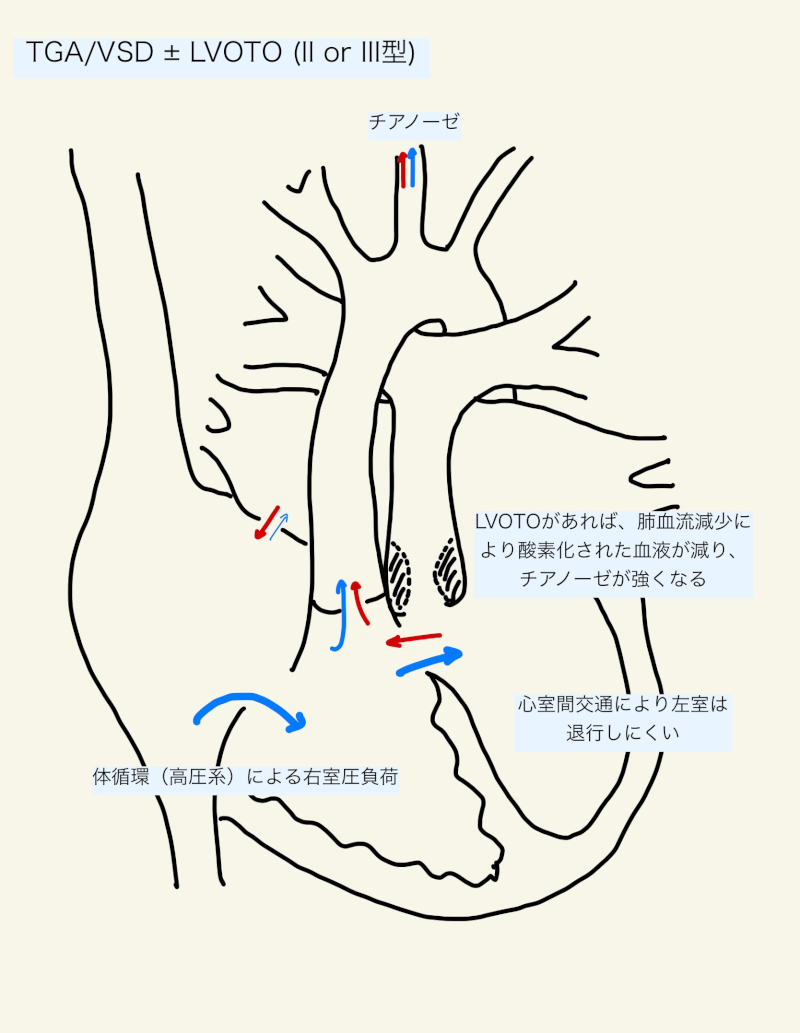
VSDの存在により肺血流とmixingが少しは期待できるが、心室間交通はmixingにそこまで有効ではなく(⇒「左室から肺動脈」「右室から大動脈」という血流の方向は依然として残る)、その場合はチアノーゼを呈する。
心房間交通がない場合、低圧系の左室から高圧系の右室には血液が流れにくい。チアノーゼを改善させ、酸素化の良い血液を上行大動脈(頭部や冠動脈)に送るためには、結局は心房間交通(による「肺静脈→左房→右房→右室→大動脈」への酸素化された血流)が必要となることが多く、心房中隔裂開術(下記参照)が行われることが多い。
TGA/IVS(I型)と同様に、シャントと体循環維持による右室の容量負荷・圧負荷となる。肺血流増加による左室容量負荷に加え、心室間交通の存在によって左室が体血圧へ曝露されるため、(III型だけでなく)II型であっても左室の圧負荷となり、左室は退行しにくい。
II型では、全身血管抵抗と肺血管抵抗の差による右室から左室へのシャントで肺血流が増加し、(特に肺血管抵抗が低下する生後2、3週で)うっ血性心不全になりやすい。いわゆる、「High-flowなのに低酸素」という状態。左室は退行しにくいが、肺血管閉塞性病変に発展する危険がある1)。肺血管抵抗が上昇し肺高血圧となると低酸素が増悪し、外科的選択肢が制限され予後が悪化する。その点では早期の手術が必要となる(ex. できるだけ早く〜生後6週以内22,23))。
左室流出路狭窄がある場合(III型)、肺血流が減少し、左房・左室に灌流する血液も減少する。酸素化された血液の混合が小さくチアノーゼと低酸素血症を呈するが、II型のようなhig-flow・うっ血性心不全にはなりにくい。バランスさえとれていれば(心房間交通によるmixing+心室中隔欠損による左室の退行予防+左室流出路狭窄によるhigh-flow予防・肺血管保護)、体重増加(ex. >=10kg)を待って待機的に手術を行うこともある。
方針
プロスタグランジン(Prostaglandin E1: PGE1)
低酸素を伴うTGAの殆どの症例において、動脈管を開存させるPGE1は有効である。ただし、以下のような注意点がある。
- 薬の副作用として、無呼吸(2kg未満の新生児で投与後1時間以内に多い)、発熱、皮膚紅潮(血管拡張による)、徐脈、低血圧、浮腫、痙攣、血小板機能低下、汎血球減少、発熱がある。
- 過剰な肺循環によりうっ血性心不全の傾向は高まる。
- 心房間交通が制限的の場合にはPGE1のみでは改善せず、左房圧上昇、肺うっ血、低心拍出症候群から緊急のBASが必要な状態に陥ることがある11,15)。この場合、生後の左房圧上昇により肺血管抵抗の低下が遅れ、心房間交通作成後も十分なミキシングを得られにくい。心エコーで、PDAやASDを介した右左シャントが確認でき、前述のような”Reverse differencial cyanosis”となる15)。
- 大動脈から肺動脈へのシャントにより腹部臓器への血流が低下し、内臓酸素飽和度の低下や壊死性腸炎(necrotising enterocolitis)を引き起こす可能性がある。
- 動脈血酸素飽和度が維持されたとしても、PDAを介したrun-offにより脳組織酸素飽和度は低い可能性があり16)、低酸素による神経学的な影響もある6)。動脈血酸素飽和度が良いからといって安心してはいけない11,15)。
バルーン心房中隔裂開術(Balloon atrial septostomy: BAS)
心房間交通によるmixingを増やすための緊急対応策(ex. 心房間交通がrestrictiveでSpO2<=70%)。肺静脈うっ血も軽減させ、左房・左室の圧迫を解除できる。殆どの新生児はBASの後に改善するが、改善しない場合は肺高血圧(ex. 新生児遷延性肺高血圧: PPHN)の存在を示唆する。
動脈血酸素飽和度や脳酸素飽和度を改善させる12)が、心房性不整脈や心房穿孔、心タンポナーデ、脳卒中(←strokeに関してはconflicting dataあり)の危険がある11,15)。
肺動脈絞扼術
低出生体重児や未熟児、壊死性腸炎、敗血症など、生後2-3週で大血管転換術を施行できない患児に対しては、肺動脈周囲にバンドを留置し、左室後負荷を増加させることで、左室重量を増やす「トレーニング」を施行する。
YacoubらはPAB後数ヶ月でASOを施行する(two-stage ASO)ことを初めて報告したが、JonasらによってPAB後1-2週間でASOを施行する”rapid two-stage ASO“が提唱された。これは、乳児ではPAB後数日で左室心筋重量が増加することが示されたからである24,25)。
ASO体循環の心室(右室)の半分から三分の二程度の圧になるように調節され、大血管転換術後に体血圧に対して機能できるようにする1,24)。
Blalock-Taussing手術
TGA/VSD/LVOTO(III型)で、肺血流が少なく動脈管混合が限定されており、患児が小さくRastelli手術を施行できない場合に考慮。また、左室トレーニングに際し肺動脈絞扼術で減った肺血流の埋め合わせに併用。
心房内転換術(Senning/Mustard手術)
心房内にバッフルを作成し、全身静脈血を左室に、肺静脈血を右室に流す。Senning手術では自己心房組織を用いるのに対し、Mustard手術では補填物を用いる。
心室内転換術
Rastelli手術
TGA/VSD/LVOTO(III型)の修復法。LVOTOが重度で手術による解除が難しい場合に考慮。左室と大動脈に連続性をもたせるように心室内パッチを縫着しVSDを閉鎖する(左室流出路を新たに作成)。導管を用いて右室から肺動脈に血液を流す。LVOTOの重症度によってはBTシャントを経て、Rastelli手術は1〜3歳に行われることが多い。
このように、心室内血流転換に加えて導管を用いて右室と肺動脈をつなげる手術がRastelli手術と呼ばれる。肺動脈閉鎖などで心外導管を用いて右室と肺動脈をつなげる手術は、厳密にはRastelli型手術と呼ぶべきだが、最近では用語の使用は曖昧である。
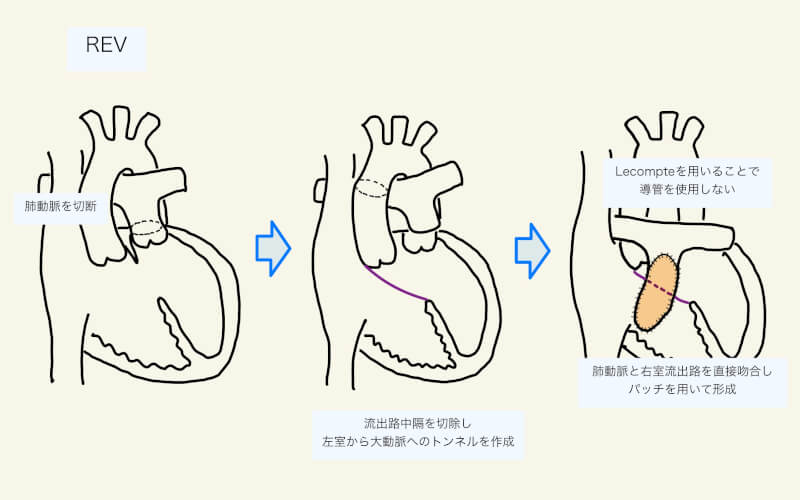
REV (Réparation à l’Etage Ventriculaire)
TGA/VSD/LVOTO(III型)に対して施行される、Rastelli手術の変法。特に右室と肺動脈の接続方法が”REV”と呼ばれ、導管を用いず肺動脈後面を右室流出路に結合し、前面はパッチを用いて再建する。肺動脈弁はmonocuspとなる。
Pulmonary root translocation
同じくTGA/VSD/LVOTO(III型)に対して施行される手術法。REVの変法。肺動脈基部を弁と共に左室から切り離し、左室側は閉鎖。VSDを拡大しパッチを用いて左室から大動脈へのトンネルを作成。肺動脈弁を含む肺動脈基部を右室に結合し、右室流出路はパッチなどを用いて形成する13,27)。REVと異なり肺動脈弁の機能あり26)。
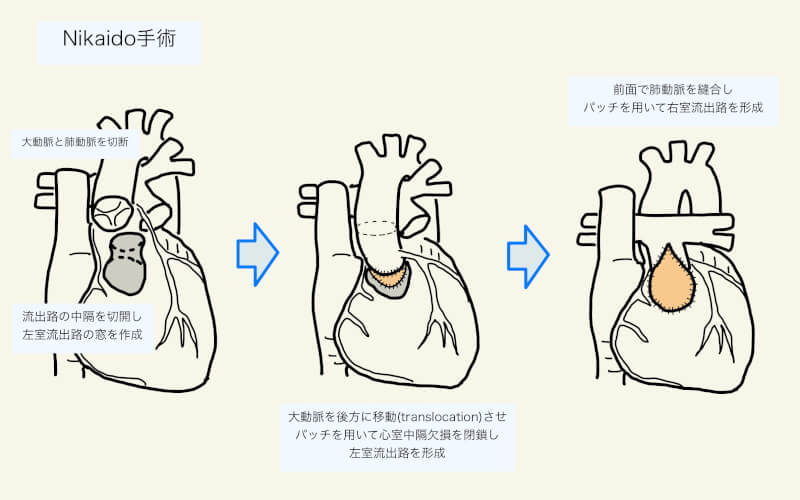
Nikaidoh手術(Aortic root translocation)
同じくTGA/VSD/LVOTO(III型)に対して施行される手術法。大動脈基部を(弁と共に)前面にある右室から切り離し後方にあるLVOTと結合する(aortic root translocation)。冠動脈が伸展や折れ曲がるようなら一度切り離して再吻合。VSDが小さければ直接閉鎖、大きければpatchで閉鎖。その後、前面で右室流出路を形成する。パッチや導管を用いて右室と肺動脈をつなぐ。肺動脈分岐部を上行大動脈の左前に無理やり位置させることで狭窄の危険がある場合は、Lecompte(下記参照)により肺動脈分岐部を大動脈の前面に移動させることもある。Rastelli手術よりも左室と大動脈が直線的な関係となる。
TGA/VSD/LVOTO(III型)に対して行われる手術は複数あるが、A) 大動脈・肺動脈の流出部位、B) 右室-肺動脈結合、の2つの視点から考えると良い26)。
A. 大動脈・肺動脈の流出
・Re-routing:ex) VSDを介した左室から大動脈へのトンネル
・Translocation:ex) 大動脈を左室へ移動させ、VSDを閉鎖
B. 右室-肺動脈結合
・肺動脈(弁)組織
- 自己組織を含まない:Rastelli手術
- 自己組織を含む:REV、pulmonary translocation
・弁機能
- 無:REV、Nikaido手術
- 有:pulmonary translocation
大血管転換術(Arterial Switch Operation: ASO)
上行大動脈は交連部上で切断。大動脈は左室流出路に吻合、肺動脈は右室流出路に吻合する。冠動脈は、旧肺動脈(新生大動脈)の基部に移植。“Anatomic” coorrectionと呼ばれるが、肺動脈弁が体血管の弁として機能しなければならず、中長期的には弁逆流や大動脈基部の拡張が問題となる。
最近は殆どのTGAに対して施行される。左室心筋量が成功の鍵。TGA/IVS(I型)では、肺血管抵抗が生後数週で生理学的に低下するに従って、左室圧は低下する。そのため、ASO後に体血管に拍出する能力が退行してしまうため、その前(出生後2、3週以内1))にASOを施行する1)。
手術を数日遅らせることにより、肺血管抵抗の低下、肝腎機能の成熟、経腸栄養開始といった利点がある一方で、BASの必要性やBASによる合併症、PGE1やPDA依存性の循環、奇異性塞栓といった合併症の危険が上がる11)。特に、TGA(やHLHS)患者の脳酸素飽和度低下・脳傷害6,7)や合併症の発生率の観点3,4,5)から、最近はより早期(生後3-5日)での手術が最も成績が良いとされている11)。
TGA/VSD(II型)では肺高血圧のため左室圧は高いままであり、生後4週を過ぎてもASOは可能。患児が安定して成長している場合は生後6-8週でASOを目指す。しかし実際には、難治性心不全や肺血管閉塞性病変が起こる前に、生後1ヶ月以内にASOを施行することも多い1)。
TGA/VSD/LVOTO(III型)では、左室流出路狭窄を手術で解除できるならASOの適応。LVOTOの解除が難しいなら上述のようにRastelli手術など他の術式を考える。
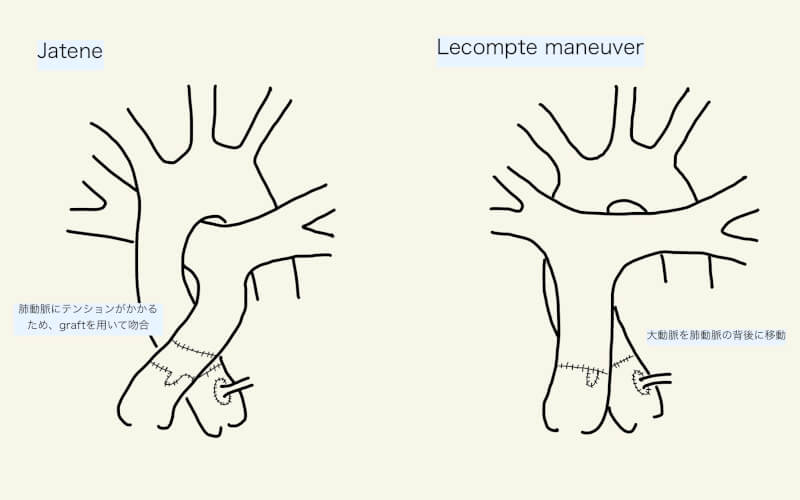
1975年にJateneが報告したASOでは、当初はグラフトを用いず大動脈と肺動脈をそれぞれ左室と右室に吻合していた。しかし、肺動脈側がしばしばテンションが加わり狭窄する傾向にあったため、導管やグラフトを用いて吻合するようになった2)。1981年にLecompteらは、大動脈を肺動脈の背後に移動させることで、肺動脈へのテンションを減らしグラフトを使用しない方法を報告した(Lecompte maneuver)1,2)。
術前チェック項目
TGAの病態生理を踏まえ、術前は以下の項目をチェックする。
- PDA/ASD/VSD/LVOTOの有無(型の分類)
- 循環間混合の程度:心房間交通の存在や、それが十分な混合となっているか。チアノーゼ、うっ血性心不全や過剰肺循環の症状・徴候の有無。
- 左室拡張末期容量・左室心筋重量(ex. >35g/m2)・左室後壁厚(ex. >=3.5mm)・心室中隔の形(ex. “banana-shape”ではない)19,20,21):左室の術後の機能予測。TGA/IVS(I型)では肺血管抵抗低下に従って、左室が退行する。ASO成功の鍵。
- バルーン心房中隔裂開術の施行歴と、その改善の程度。
- プロスタグランジン依存性の循環の存在。あれば、人工心肺確立まで継続。
- 冠動脈の解剖:大血管転換術の予後は冠動脈を新生大動脈に捻れや狭窄なく移行することに依存する。単一冠動脈や壁内走行を有するパターンはリスク因子18)。
- その他:現時点での呼吸・循環の補助
周術期管理
術前・術中管理
心拍数・心収縮力・前負荷を維持し心拍出量を維持することが重要。心拍出量の低下は肺血流を減少させ、血液混合の低下・動脈酸素飽和度の低下を招く。
肺を通る有効血流を確保するため、肺血管抵抗を全身血管抵抗よりも低く保つ。肺血管抵抗が増加すると肺血流が低下し循環間混合が減少する。換気を調節し、アシデミア、低体温、低酸素を避ける。ただし、左室容量負荷とうっ血性心不全を呈したTGA/VSD(II型)患者では、換気の調節により肺血管抵抗を減らしても、動脈血酸素飽和度が若干改善するのみで全身灌流が犠牲なるため、不要である1)。
PGE1は、動脈管の開存を維持させ、組織酸素供給を改善させる。肺血管抵抗が高ければ動脈管を介した肺血流が減少する。このような場合、鎮静、挿管、筋弛緩、機械換気によって肺血管抵抗を低下・肺血流量を増加させ、換気血流不均衡を改善させる。BAS後など、心房間交通が十分の場合には、術前にPGE1を中止できる場合も多い1)。全身血管抵抗を高めに保ち、全身静脈血の再循環を避け、更なる動脈血酸素飽和度低下を防ぐ1)。
肺血管抵抗の低下により酸素化が改善した後は、肺血管抵抗を調節し、過度な肺循環と酸素供給量の低下を防ぐ15)。
人工心肺&離脱後
大動脈再建後(肺動脈吻合前に)、大動脈遮断を解除する。肺動脈再建とASD(・VSD)閉鎖の完了後に人工心肺を離脱する。 当初はDHCAが標準であったが、大動脈狭窄病変がある患者を除き、低体温・低流量で行われることが多い17)。
目標は、十分な心拍出量を維持しつつ、可能な限り左房圧を低下させ肺高血圧を防ぐこと。不安定な血行動態や、心筋浮腫や拡張による心拡大がある場合は、後日の胸骨閉鎖を考慮する。ASOを施行されたd-TGAの新生児は通常早期抜管の適応ではない。
左室機能をしっかり評価
人工心肺後の心筋機能障害の原因としては、冠動脈の空気、不十分な冠動脈移植、不十分な心筋保護、元々の左室重量低下などが考えられる。心内の遺残空気による冠動脈塞栓による左室機能低下や不整脈を防ぐため、大動脈遮断後(肺動脈吻合前)に経食道心エコーで遺残空気をよく観察し、ルートベントからの排除を促す。大動脈遮断解除後に直ぐに自己脈が出現することは、冠動脈灌流や心筋保護が良好である一つの兆候である。また、新大動脈弁(旧肺動脈弁)の逆流は、再建大動脈の捻れや形成不良が疑われるため、遮断解除後に評価する。
左房圧は、左室機能不全を反映するため特に有用で、術後早期は残しておくべきである。左房の過伸展は、過剰な左室前負荷を反映し、収縮力を低下させるため避けるべきである。また、修復後は肺動脈が大動脈の前面で冠動脈起始部と近接しており、左房の伸展は肺動脈の拡張を引き起こし、冠動脈を圧迫するため、左房過伸展は避けるべきである1)。肺高血圧を引き起こす他の病態も、同様の影響を及ぼす1)。
残存病変を評価
経食道心エコーで残存病変を評価する。
Major Residual Regionの例10,15)
残存シャント
- 心房間・心室間のresidual defect >3mm
弁逆流
- 新生大動脈弁・肺動脈弁逆流:中等度以上
- 右房室弁逆流(特にVSD閉鎖後):中等度以上
- 僧帽弁逆流(冠動脈の異常を疑う)
狭窄
- 新生大動脈弁・肺動脈弁狭窄:peak velocity >3.2m/s
- 大動脈・肺動脈吻合部狭窄:peak velocity >2.7m/s
- 左右の肺動脈狭窄:peak velocity >3.2m/s
- 左室(術前大動脈縮窄症や離断症患者の狭窄病変)・右室流出路狭窄(弁下。術前LVOTO):peak velocity >3.2m/s
術後管理
循環は、臨床的判断と侵襲的モニタリングのデータを合わせて総合的に判断する。平均血圧>40 mmHgを目標とし、血清乳酸を灌流のマーカーとして用いる。冠血流を保つためにある程度の圧は必要であるが、過剰な大動脈圧は左室の後負荷となるため、術前右室圧以上の左室圧は避けるべきとの考え方もある。左房圧の目標は5-8 mmHg1)。血管内輸液を術当日は正常の50%に制限する。輸液は注意深く投与すべきで、少量の輸液でさえ劇的に左房圧を上昇させうる。通常、平均左房圧>10 mmHgとなるような輸液負荷によって血行動態が改善することはない1)。
術後24時間以内の左心不全に注意する8)。原因は、人工心肺後非特異的低心拍出量症候群、術前左室圧が高くなくトレーニングされていない左室による機能不全、冠動脈灌流低下などが考えられる。持続する体低血圧、左房圧上昇、末梢灌流低下を認めた際は、迅速に冠動脈の評価をすべきである。肺高血圧クリーゼや肺動脈吻合部の狭窄による右室圧上昇などによって右心不全も起こりうる。
その他、出血や不整脈は勿論のこと、痙攣、腎不全、横隔神経麻痺、声帯麻痺などが起こりうる。また、d-TGA患者ではコイル塞栓を要するような側副血行路9)があり、コイルを要する。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- Dunn et al. Ann Thorac Surg. 1991 Mar;51(3):511-3.
- O’Byrne et al. Circulation. 2018 Nov 6;138(19):2119-2129.
- Anderson et al. J Am Coll Cardiol. 2014 Feb 11;63(5):481-7.
- Cain et al. World J Pediatr Congentital Heart Surg. 2014 Apr;5(2):241-7.
- Petit et al. Circulation. 2009 Feb 10;119(5):709-16.
- Lynch et al. J Thorac Cardiovasc Surg. 2018 Oct;156(4):1657-1664.
- Wernovsky et al. Circulation. 1995 (PMID 7554206)
- Wipf et al. Int J Cardiol. 2018 (PMID 29444748)
- Nathan M, et al. J Am Coll Cardiol. 2021 May 18;77(19):2382-2394. PMID: 33985683.
- Villafañe J et al. J Am Coll Cardiol. 2014 Aug 5;64(5):498-511. PMID: 25082585.
- van der Laan ME et al. Pediatr Res. 2013 Jan;73(1):62-7. PMID: 23095977.
- da Silva JP et al. J Thorac Cardiovasc Surg. 2012 Jun;143(6):1292-8. PMID: 22154787.
- Yap SH, et al. Pediatr Cardiol. 2009 Apr;30(3):359-62. PMID: 18923862.
- Wernovsky G. Pediatr Crit Care Med. 2016 Aug;17(8 Suppl 1):S337-43. PMID: 27490620.
- Kurth CD, et al. Ann Thorac Surg. 2001 Jul;72(1):187-92. PMID: 11465176.
- Rastan AJ, et al. Eur J Cardiothorac Surg. 2008 Apr;33(4):619-25. PMID: 18243007.
- Pasquali SK, et al. Circulation. 2002 Nov 12;106(20):2575-80. PMID: 12427654.
- Lacour-Gayet F, et al. Eur J Cardiothorac Surg. 2001 Oct;20(4):824-9. PMID: 11574232.
- Ota N, et al. World J Pediatr Congenit Heart Surg. 2018 Jan;9(1):74-78. PMID: 29310554.
- Foran JP, et al. J Am Coll Cardiol. 1998 Mar 15;31(4):883-9. PMID: 9525564.
- Dibardino DJ, et al. Ann Surg. 2004 May;239(5):588-96; discussion 596-8. PMID: 15082962.
- Wetter J, et al. Eur J Cardiothorac Surg. 2001 Oct;20(4):816-23. PMID: 11574231.
- Sarris GE Chairperson Greece, et al. Eur J Cardiothorac Surg. 2017 Jan;51(1):e1-e32. PMID: 28077506.
- Marathe SP, et al. Ann Pediatr Cardiol. 2015 May-Aug;8(2):122-8. PMID: 26085763.
- Salem A. Heart Surg Forum. 2020 Oct 15;23(6):E770-E773. PMID: 33234212.
- da Silva JP, et al. Ann Thorac Surg. 2000 Feb;69(2):643-5. PMID: 10735726.
コメント
コメント一覧 (4件)
[…] DORVでは、両大血管が完全にもしくは主に右室から起始しており、ほぼ全ての患者がVSDを合併する(この定義によると、DORVは多様な疾患を含み、後述するように形態学的にはファロー四徴症(TOF)や大血管転位(TGA)に似たようなものもある)。 […]
[…] Double switch(Senning + ASO)、Senning/Mustard + […]
[…] 姑息的な大血管転換術(Arterial Switch Operation: ASO)を施行し、閉塞のない左室から大動脈へ駆出できるようにする。 […]
[…] 完全大血管転位(uncorrected TGA / d-TGA) […]