以下、修正大血管転位(Congenitally corrected TGA)の周術期管理について、麻酔科医・集中治療医が把握すべき事項について解説します。
解剖・分類
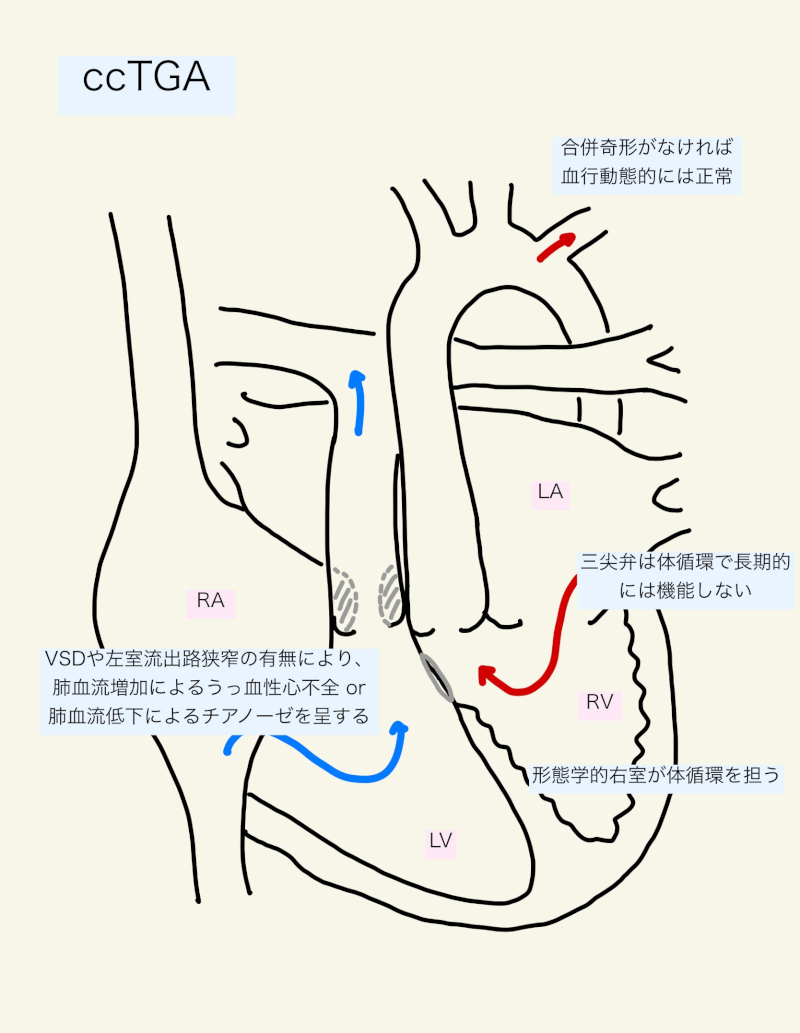
修正大血管転位は、levo-TGA、ccTGA, L-TGAとも呼ばれる。心房心室間の不一致(AV discordance)と心室動脈間の不一致(VA discordance)と定義され、右房は右側にある僧帽弁と形態学的左室を介して右側にある肺動脈へ結合する。左房は左側にある三尖弁と右室を介して大動脈へ結合する。
心房心室間と心室動脈間の不一致だけでは生理学的異常やチアノーゼを引き起こさないが、以下のような合併症の存在し、問題点を引き起こす1,2,3)。
- 単発・多発心室中隔欠損(VSD)(50-80%)
- 左室流出路狭窄(50%):肺動脈閉鎖や肺動脈弁下狭窄。弁下狭窄は、三尖弁組織や線維性弁輪の突出、筋性トンネルの存在による3)。
- 三尖弁異常(25-90%):異形成のことが多く、中隔尖や後尖が心尖部方向に移動した”Ebsteinoid tricuspid valve“のことがある3)。
- 房室弁の位置異常(straddlingやoverriding)
- 房室結節の位置異常や房室伝導系の異常(ex. 完全房室ブロック):洞房結節は正常であるが、房室結節は心尖部よりの右房前表層に存在し、二つ目の房室結節が存在することもある3,5)。His束やその枝の走行も異常であることがある3)。
- 心室低形成
- 冠動脈異常:右側から左前下行枝と回旋枝が、左側から右冠動脈が起始。単一冠動脈のこともある3,5)。
- 右胸心
病態生理
ccTGAでは、酸素化されていない血液は肺で酸素化され、体循環に送り出される。形態学的左室が肺循環への心室として働き、酸素化されていない血液を肺動脈へ駆出する。左房が酸素化された血液を肺静脈から受けとり、形態学的右室を通して大動脈へ送り出す。すなわち、合併奇形がなければ生理学的には修正されており、血行動態的には正常である。
駆出率の低い形態学的右室は、拡張末期容量を増加させて心拍出量を保つ。しかし、右室と三尖弁は、体循環において長期間機能するような構造ではない。小児期は運動によって形態学的右室の駆出率が増加するが、成人ではこのような右室の予備能は失われ、経年的には安静時の右室機能も低下(体心室機能不全)する3,5)。三尖弁の形態学的異常や右室の拡張による弁輪拡大により、三尖弁逆流が問題となる3)。また、刺激伝導系は経時的に変性・線維化し、房室ブロックを代表とした不整脈を引き起こす3)。
ccTGAは、その解剖や生理学的特徴によって以下のように分類することができる1)。
1) ccTGA/IVS:VSDなし(Intact Ventricular Septum)
2) ccTGA/VSD:VSDあり
ccTGA/VSDは、左室流出路閉塞性病変の有無と程度により、更に3つに分けられる
– 2-a) 軽度の肺動脈狭窄
– 2-b) 肺動脈閉鎖や重度肺動脈狭窄
– 2-c) 肺静脈閉塞性病変
合併症のない孤発性のccTGAの場合は、成人時期になって診断されることもある3)。典型的な症状としては、20歳代から増加する完全房室ブロックによる失神発作や運動耐容能低下が挙げられる3,5)。長期的には形態学的右心機能不全や三尖弁逆流による心不全症状が出現する3)。一方、老年期まで手術をせずに生存する稀なケースも存在する。
VSDがあり左室流出路閉塞性病変がないもしくは小さい患者では、体循環にある右室不全からうっ血性心不全となる。特記すべきは、体循環の弁は三尖弁であり、体血圧への暴露により弁閉鎖不全を引き起こすことである。これにより、VSDのためQp/Qsがすでに上昇し容量負荷がかかっている形態学的右室への、更なる容量負荷となってしまう5)。
VSDと重度の左室流出路閉塞性病変がある患者では、肺血流が減少しチアノーゼが出現する。加齢とともに肺動脈狭窄が徐々に進行し、チアノーゼが増悪することもある3)。
方針
手術のタイミングは未だ議論中であるが、外科的介入(と再介入)には以下の様な適応が提唱されている4)。
- VSD、残存VSD
- 中等度以上や悪化する三尖弁逆流
- 左室流出路狭窄>60mmHg(引き抜き法)
- 症状のある完全房室ブロック、進行性の徐脈、運動による心拍数反応性悪化
- その他の症状の悪化
- 右室機能低下
様々な外科的選択肢があるが、どちらの心室が術後の体循環の心室となるかによって、三つのカテゴリーに分類される1)。
- 形態学的右室からの体循環:古典的(生理的)修復術 + 三尖弁修復/置換術
- 形態学的左室からの体循環:解剖学的修復術 –> Double switch(Senning + ASO)、Senning/Mustard + Rastelli
- 左室と右室からの体循環:Fontan手術
古典的(生理的)修復術
ccTGAに対する「生理的修復術」は、ccTGA/VSD や左室流出路狭窄のある患者に対し、VSDを閉鎖し、左室流出路狭窄解除や導管の使用(Conventional Rastelli: 左室と肺動脈を導管を用いてつなぐ)、弁修復や置換を行い、左室流出路狭窄のないccTGA/IVSと似た状況を作り出すものである。
右心機能や三尖弁機能が良く、バランスのとれた心室を持ち、解剖学的修復術の相対禁忌(僧帽弁機能不全、冠動脈異常、小な心房、右胸心など)の場合に適応となる1)。
しかし、三尖弁は体循環において長期間機能するような構造ではないため、エブスタイン奇形のような長期的な機能不全に陥る。しばしば再手術が必要となり、一般的には導管の再置換や三尖弁(体循環の房室弁)修復・置換が多い5)。
解剖学的修復術
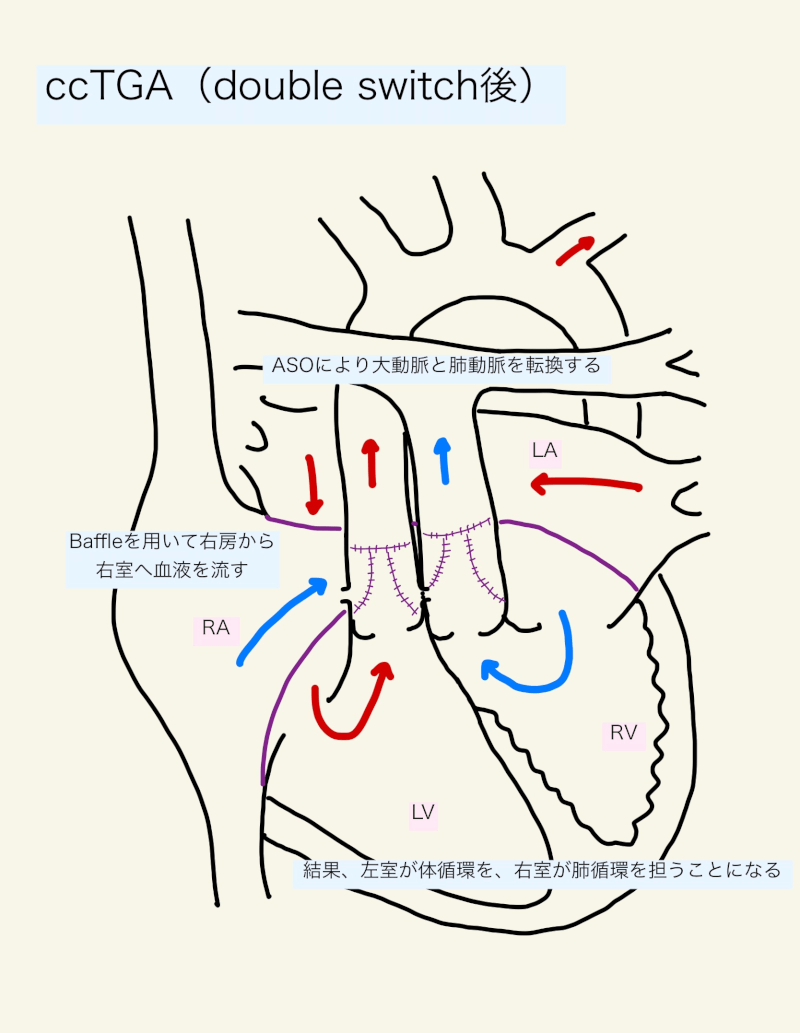
解剖学的修復術は、Double switchと呼ばれる大血管転換術(Arterial Switch Operation: ASO)+ 心房転換術(Senning/Mustard)か、心房転換術(Senning/Mustard) + Rastelliを指す用語である。これにより、心房心室間と心室動脈間を一致させることができる。形態学的左室が体心室となるため、古典的修復術のような形態学的右室の圧負荷を回避し、進行性の右室機能不全や三尖弁閉鎖不全を減らすというメリットがある。
一般的に、僧帽弁の機能が良く、両心室のバランスが取れている場合は適応になる1)。左室低形成は解剖学的修復術の適応外であり、左室は右室の50%以上の大きさが必要である5)。右室が低形成の場合には、右左シャントによる心拍出量の確保を目的に、心房baffleにfenestrationを作成することがある5)。右室機能や三尖弁機能が悪い患者では生理的修復術による予後が不良のため、解剖学的修復術の適応となる1)。
Double switch procedure
手術は、ASOとMustard/Senningが組み合わされる。まず、VSDを閉鎖し、大動脈と肺動脈はそれぞれの心室にスイッチする(ASO)。僧帽弁と形態学的左室は体循環の房室弁と心室となり、三尖弁と形態学的右室は肺循環の房室弁と心室となる。最後に、MustardかSenningにより、心内baffleによって血流を右房から三尖弁を通して形態学的右室へ流し、左房からの血液は左室に向かうようにする。手術時期は生後数ヶ月から数年と様々である。
自己心房組織を用いて心房スイッチを行うSennningでは、心房容積が小さくなることで術後早期に静脈路の狭窄や低心拍出症候群を呈することがある。心内補填物を使用するMustardは、心尖部が右もしくは正中方向(dextrocardiaまたはmesocardia)で心房が心室後方に存在し、心房サイズが小さい場合に選択される5)。術後早期に安定した血行動態を得やすいが、遠隔期の静脈還流路狭窄が問題となることがある。
肺動脈弁と左室流出路が正常である(狭窄がない)場合に適応となる5)。ただし、軽度または動的な狭窄は、左室の退行を防ぐという意味では利点に働く5)。大きなVSDがあり乳児期に手術を行う場合は、すでに左室のpreconditioningがされているという点で、後述の様な左室のトレーニングは必要ない。
VSDのないccTGA/IVSである場合や、以前に生理学的修復術を施行されていた場合、解剖学的左室が退行している場合がある。その際(ex. 左室圧が体血圧の70%以下5))、左室を「トレーニング」するため、ダブルスイッチを行う前に肺動脈絞扼術(PAB)を行うこともある。
Senning/Mustard and Rastelli
Baffleを用いて血流を右房から三尖弁を通して形態学的右室へ流し(Senning/Mustard)、左室からVSDを経由して大動脈に血流路を再建する。VSDを介した大動脈への経路を確保のため、漏斗部切開やVSDの拡大を要することがある。右室から肺動脈へ弁付き導管を留置(Rastelli)する。
VSDと右室流出路狭窄がある場合(ccTGA/VSD/RVOTO)に適応となる1)。VSDと右室流出路狭窄のため、左室は退行しておらず、左室のトレーニングは不要である6)。
Fontan手術
Fontan手術は、両心室を全身循環に用いるもので、解剖学的理由より二心室修復が向いていない患者に対して考慮される。特に、大きなVSDや左室流出路狭窄病変が複雑で心室を隔てることが難しい場合に適応となる1)。
術前チェック項目
心エコーでは
- VSDの有無とシャントの方向:分類や血行動態に関与。
- 左室流出路(肺動脈)の形態:狭窄部位(弁または弁下狭窄)とその機序。狭窄の程度が、チアノーゼ vs. うっ血性心不全に大きく関与。
- 三尖弁の形態と逆流の有無:異形成(弁尖の肥厚や短縮)やEbstein奇形のような中隔尖と後尖の心尖部方向への移動3)。三尖弁逆流の程度は体循環に関与し非常に重要。
- 形態学的右室機能:経時的に低下する。手術の成績にも関与し非常に重要3)。
- 左室・右室拡張末期容量:左室が低形成ならダブルスイッチの適応外。
- 僧帽弁の機能:僧帽弁が低形成ならダブルスイッチの適応外。
- 冠動脈の異常:特にダブルスイッチの術式に関与5)。
を評価する。
心臓カテーテル検査では、上記の項目に加え、
- 中心静脈圧・左室圧・右室圧・肺動脈圧・大動脈圧
- 肺血管閉塞性病変の存在と肺血管拡張薬への反応性
も評価する。
周術期管理
古典的修復術
それぞれの手術において、病態整理と起こりうる合併症を把握している必要がある。例えば、古典的修復術では、術前と同様に術後も右室が体循環を担うため、右心不全(体心室機能不全)に対する管理が必要となる。特に術前の右室機能が低下している症例は、右心不全(体心室機能不全)は術後も問題となりやすく、酸素需要量増加に対する反応性が低い。体循環の房室弁逆流は循環に大きく関与するため、心拍数や後負荷の過度な上昇は避ける。古典的修復術後のペーシングを要するような完全房室ブロック発生率は高く、特にVSD閉鎖や左室流出路狭窄(肺動脈狭窄と肺動脈弁下狭窄)解除で問題となる5)。
解剖学的修復術
ダブルスイッチでは人工心肺時間が長くなるため、心筋や各臓器傷害が起こりやすい。房室ブロックはダブルスイッチでも問題となり、特にRastelliでVSDを介した大動脈への経路を確保するために漏斗部中隔を切開した際には、伝導系が傷害され、術後の房室ブロックを起こしやすい5)。心房性不整脈も問題となるが、d-TGAに対する心房内転換術と比べると少ない5)。これは、d-TGAに対する心房内転換術では、心房切開や縫合線だけでなく、右室機能不全や三尖弁閉鎖不全による心房負荷が心房性不整脈の原因となるが、ccTGAのダブルスイッチでは体心室が左室になるからだと考えられる5)。冠動脈の起始や走行、弁の位置等の問題により、ccTGAのASOにおける冠動脈の移植は技術的に難しい5)。ASO同様、冠動脈に関連する合併症(ex. 不整脈、血圧低下、低心拍出量、出血など)に注意し、経食道心エコーで心内バッフルの狭窄や、新大動脈や新肺動脈の狭窄や逆流といった残存病変をチェックする。右室から肺動脈へ導管(Rastelli)が使用された症例では、胸骨閉鎖による導管の圧迫・狭窄に留意する。
Fontan手術
Fontan手術については、こちらを参照。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- Karl TR. Ann Pediatric Cardiologist. 2011 Jul;4(2):103-10.
- Congenital Heart Disease in Adults, English Edition. Jana Popelova et al.
- Therrien J, et al. Can J Cardiol. 2001 Oct;17(10):1029-50. PMID: 11694894.
- Dyer K, et al. Curr Treat Options Cardiovasc Med. 2003 Oct;5(5):399-407. PMID: 12941208.
- Mainwaring RD, et al. J Thorac Cardiovasc Surg. 2020 Jun;159(6):2356-2366. PMID: 31761342.
コメント
コメント一覧 (3件)
[…] 修正大血管転位(Congenitally corrected TGA / ccTGA / L-TGA) […]
[…] アイディアとしては、修正大血管転位(ccTGA)に対するPABに由来している。ccTGAで左室流出路狭窄のない患者では、左室の退行予防(またはトレーニング)としてPABを施行することで、右室の拡張を防ぐ効果も期待されている。 […]
[…] 最も多いのは、右側に左室型単心室が存在した大血管転位(AV discordance & VA discordance)のあるDILVである1)。 […]