以下、心房中隔欠損症(Atrial septal defects: ASD)の周術期管理に際し、麻酔科医・集中治療医が把握すべき事項について解説します。
解剖・分類
発生学上、心房中隔は以下のような特徴がある1)。
右房と左房は通常、一次中隔と二次中隔という二つの中隔によって分けられている。
胎生期に一次中隔が後方で発生し、心内膜床方向に伸びていくが完全には閉鎖せず、一次孔となる。その後一次中隔に孔があき、二次孔が形成される。二次中隔は前方に発生し、一次中隔の右側で一次孔と二次孔を超えるように進展するが、わずかに開いた部分が卵円孔と呼ばれる。一次中隔は後退し、左房側で卵円孔の弁となる。
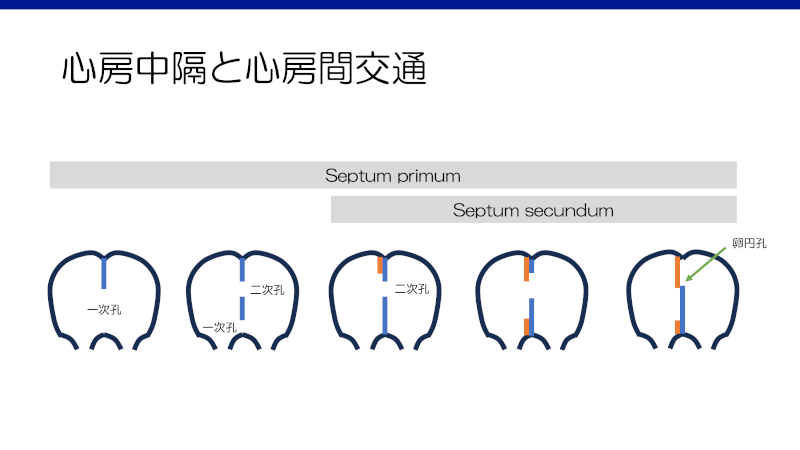
このような発生学的特徴と発生部位により、ASDは以下の5つの型に分けられる1)。

二次孔欠損型(Secundum ASD)
ASDの80%を占める。欠損孔は、卵円窩(Fossa ovalis)の辺縁(limbus)によって囲まれた部位に位置する6)。一次中隔の異常な吸収や、二次中隔の短縮や形成不全による。これらの組み合わせにより大きな欠損となる。
一次孔欠損型(Primum ASD)
一次中隔の異常形成による。欠損孔は、心房中隔の下・後部分に位置する6)。房室弁の形成異常を伴い僧帽弁裂隙を合併する(心内膜床欠損症の中間型)。
静脈洞型(Sinus venous ASD)
二次中隔や静脈洞の異常形成による。最も一般的な型は、上大静脈開口部近くに位置し、右上・中肺静脈の部分肺静脈還流異常症を合併することがある。また、右下肺静脈の部分肺静脈還流異常症と関連した、下大静脈開口部近くの欠損孔も存在する。
卵円孔開存(Patent Foramen Ovale: PFO)
一次中隔と二次中隔の融合不全による。卵円孔の開存は胎児期には正常であり、胎児循環における肺をバイパスするための右左シャントとなる。出生後は左房圧上昇により一次中隔は卵円孔を塞ぐが、二次中隔に完全に融合しないことがある。加齢とともに減少するものの、健康な人の20-30%でみられる2)。
冠静脈洞型(Coronary sinus ASD)
典型的には左上大静脈遺残(persistent left superior vena cava: PLSVC)と関連し、PLSVCの流入先である冠静脈洞と左房との間に壁がない(unroof)ため、”unroofed coronary sinus (URCS)“と呼ばれる。左房から右房へ冠静脈洞を通して血液が流れ、いわゆるASDの血行動態となるが、PLSVCと左房間で血液が両方向性にmixingし、軽度のチアノーゼを呈することもある。冠静脈洞から右房への出口周囲の心房中隔の欠損を合併することもある6)。
病態生理
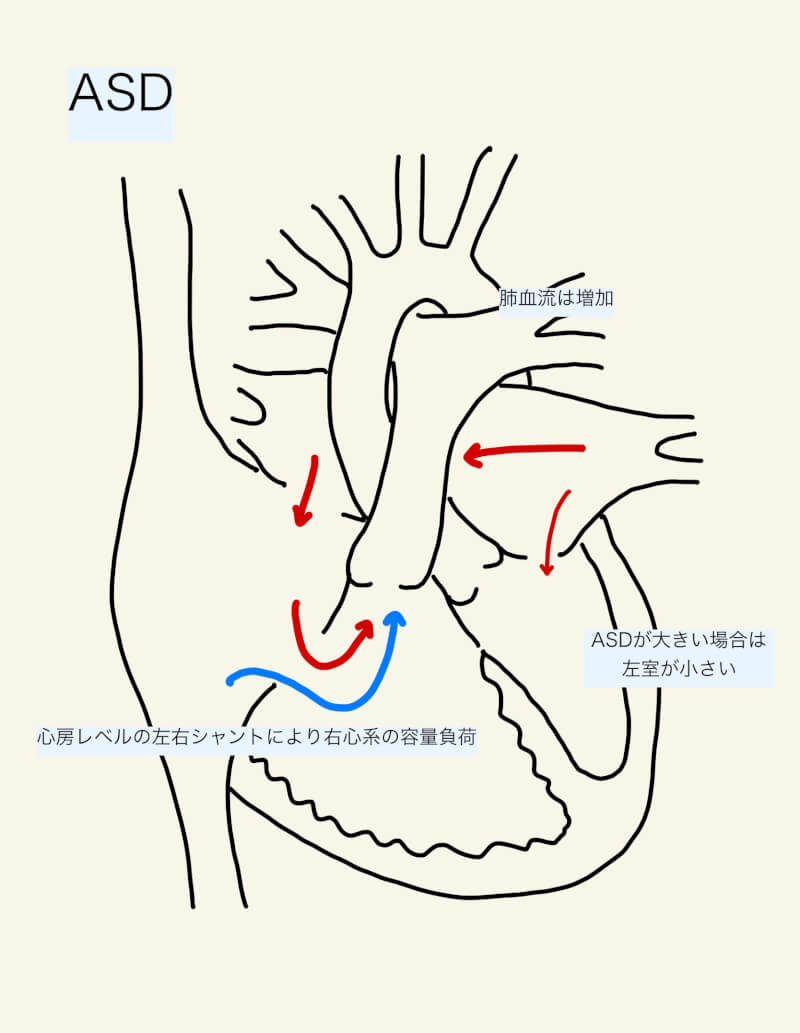
ASDのみであれば、乳児・小児期は通常無症状である。心房間の左右シャントにより肺血流は増加し肺静脈から還流する血液量も増えるが、左房に還った血液はそのまま右房へ流れることで、左房への容量負荷はそれほど大きくない。右心系に限定された容量負荷により拡張末期容量は増加し、一般的には10-20年後にうっ血性心不全となる1)。大きなASDでは左室に流入する血液量が少なく、左室の拡張末期容積はやや減少している。
心房レベルでの左右シャントは主に拡張期に発生し、シャント量は、欠損孔の大きさと心室コンプライアンスに依存する。シャント量の増加と心房拡張とともに、不整脈にリスクが増加する3)。
肺高血圧を呈することはあるが、Eisenmenger症候群への進展は稀である1)。
方針
外科的修復術
従来の方法は、人工心肺を用いた胸骨正中切開で直接またはパッチを用いて修復するものである。静脈洞型の場合は、パッチを用いてASDを閉鎖し、baffleを用いて異常肺静脈血を左房に還流させる。
近年、多くの施設では部分的胸骨切開法や側方開胸が選択されている。下記の経カテーテルASD閉鎖術が適さない患者で適応となる。
経カテーテル心房中隔欠損孔閉鎖術
カテーテル検査室などで、経食道心エコーと透視を用いて全身麻酔下で施行される。患者の大きさ(デバイス挿入のための大きなシースを挿入する必要がある)、ASDの型(通常はPFOか二次孔欠損型に限定される)、デバイスを留置するための十分な縁(フチ)があることが条件である1,4)。
術前チェック項目
心エコーでは、
- ASDの位置や大きさ:シャント量や術式に関与
- 左室拡張末期容量:左室流入血液量減少
- 右室拡張末期容量:右心系容量負荷
- 肺静脈:肺静脈還流異常症の合併
心臓カテーテル検査では
- Qp/Qs:左右シャント量
- 肺動脈血圧:肺高血圧の存在
- 肺血管抵抗:肺血流増加の罹患期間、不可逆性の肺高血圧症
を評価する。
周術期管理
術前・術中管理
アプローチ法によって体位が異なる。右側方開胸で人工心肺下に閉鎖術を施行する場合は、分離肺換気を要する。
外科的視野を改善させるためには術中分離肺換気を行うことが望ましいが、通常のダブルルーメン気管内チューブはその太さから小児への使用には向かない。Cook社のArndt気管支ブロッカーは小児に対しても使用可能であり、4.5 mm以上の気管内チューブで5Fr、6.0 mm以上で7Fr、7.5 mm以上で9Frのブロッカーを用いることができる。
ASDのみであれば患者は通常無症状であり、肺高血圧を呈していないことが多い。また、他の左右シャント病変と比較し、肺血管抵抗の変化によって循環動態が破綻するほどの心房中隔欠損症は少なく、麻酔導入のFiO2は0.8-1.0で開始しても問題ないことが多い。
経胸壁心エコーでは4本全ての肺静脈を観察することが難しいため、手術開始前に経食道心エコーにより部分肺静脈還流異常症の有無を再評価する。
人工心肺離脱後
経食道心エコーで残存ASDの有無を評価する。
必要であれば、術野より肺動脈血を、動脈圧ラインより動脈血を、中心静脈圧ラインより混合静脈血を採取し、それぞれの酸素飽和度を測定し、Fickの原理を用いた公式により左右シャントを定量的に評価する。
術後管理
殆どの患者では心機能は良好であり、周術期に強心剤は必要としない。硬膜外麻酔や肋間神経ブロックといった局所麻酔を併用することにより早期抜管が促進できる5)。単純ASDであれば、手術室または術後ICU入室後数時間以内の抜管を目指したい。
術前ASDが大きく左室への血液流流量が少ない症例では、術後左心不全となる可能性がある。過剰輸液に注意し、ある程度の心拍数を要するため、徐脈となるような薬剤の使用には気をつける。残存ASDがない限り、閉鎖後のQp/Qsは1に低下する。人工心肺の影響もあるが、通常短時間であるため心機能への影響は比較的小さい。術前のQp/Qsやうっ血性心不全の程度にもよるが、術後は利尿剤などを用いてマイナスバランスを目指す。
術後は右房切開線や閉鎖時の欠損孔辺縁の瘢痕により上室性不整脈が出現することがある。また、房室結節近辺の血腫・瘢痕が房室伝導を障害すると、房室ブロックとなる。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- Hagen PT et al. Mayo Clin Proc. 1984 Jan;59(1):17-20.
- Sealy WC et al. J Thorac Cardiovasc Surg. 1969 Feb;57(2):245-50.
- Marie Valente A et al. Am Heart J. 2007 Apr;153(4 Suppl):81-4.
- Peterson KL et al. Anesth Analg. 2000 May;90(5):1014-9.
- Transesophageal Echocardiography for Pediatric and Congenital Heart Disease, 2nd Edition. Pierre C. Wong et al. DOI: https://doi.org/10.1007/978-3-030-57193-1.
コメント
コメント一覧 (2件)
[…] 心房中隔欠損症(Atrial septal defects: ASD) […]
[…] 部分型(partial type)とも呼ばれる。心房一次中隔欠損に僧帽弁裂隙を合併する。心室中隔欠損(VSD)やその他の心室間交通は存在しない。弁輪・弁口が2つある。 […]