以下、エブスタイン奇形(Ebstein’s anomaly:EA)(+三尖弁逆流症)の周術期管理に際して、麻酔科医・集中治療医が把握すべき事項について解説します。
解剖・分類
エブスタイン奇形は以下のような特徴を持つ。
- 三尖弁の中隔尖と後尖が、正常よりも下方へ付着している(部分的または完全に心筋に付着)1,2,3)。
- 前尖の付着位置は通常は正常であるが帆のように大きく(”sail-like”)、異常な腱索によって心室壁と付着(重症患者では前尖の異常が重度)2,3)。
- 前尖組織と異常腱索、落ち込んだ中隔尖と後尖によって、様々な程度の右室流出路(漏斗部)狭窄が起こりうる2,3)。
- 下方移動した中隔尖・後弁尖付着部位と三尖弁輪との間に、”心房化右室(artrialized right ventricle)”と呼ばれるスペースができる。心房圧に暴露されており薄く、刺激伝導系の異常によりparadoxicalな動きをする1,3)。
- 機能的弁輪よりも末梢は”機能的右室(functional right ventricle)”と呼ばれる。肉柱部は小さく菲薄化しており、収縮機能が障害されている1)。
- 多くの患者で、心房中隔欠損または卵円孔開存がある1,3)。
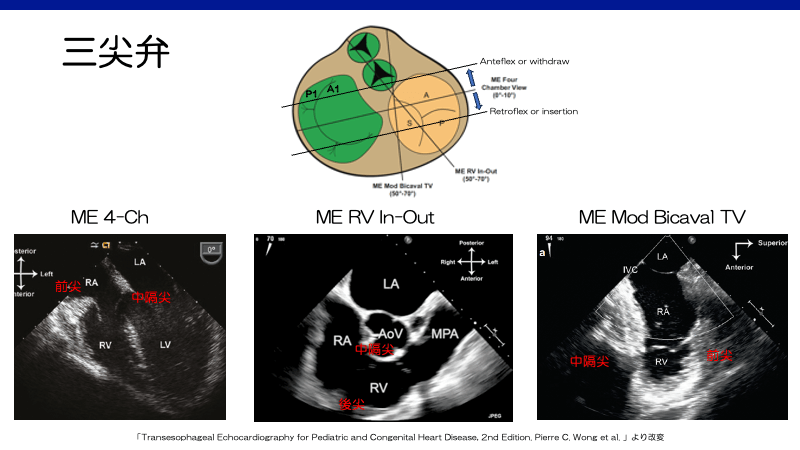
三尖弁2)
前尖(anterior), 後尖(posterior/inferior), 中隔尖(septal)の三つの弁尖をもつ。僧帽弁のように、それぞれの乳頭筋間で腱索を明確に共有することはない。
– 前尖:右室で最も発達した前外側乳頭筋からの腱索が付着。右室自由壁に隣接する。
– 後尖:右室下部から小さな乳頭筋群からの腱索が付着。
– 中隔尖:中隔の乳頭筋(septal/medial papillary muscle/papillary muscle of the conus)からの腱索が付着。右室の中隔側に存在。
最も有名な分類の一つに、Carpentier分類がある4)。右室の大きさが十分であるtype A、大きな右房化右室があり三尖弁前尖の可動性があるtype B、三尖弁前尖の可動性が制限され右室流出路が狭窄するtype C、漏斗部以外ほぼ全て右室が右房化(”Trisucpid Sac”)しているtype Dの、4つに分けられる。
病態生理
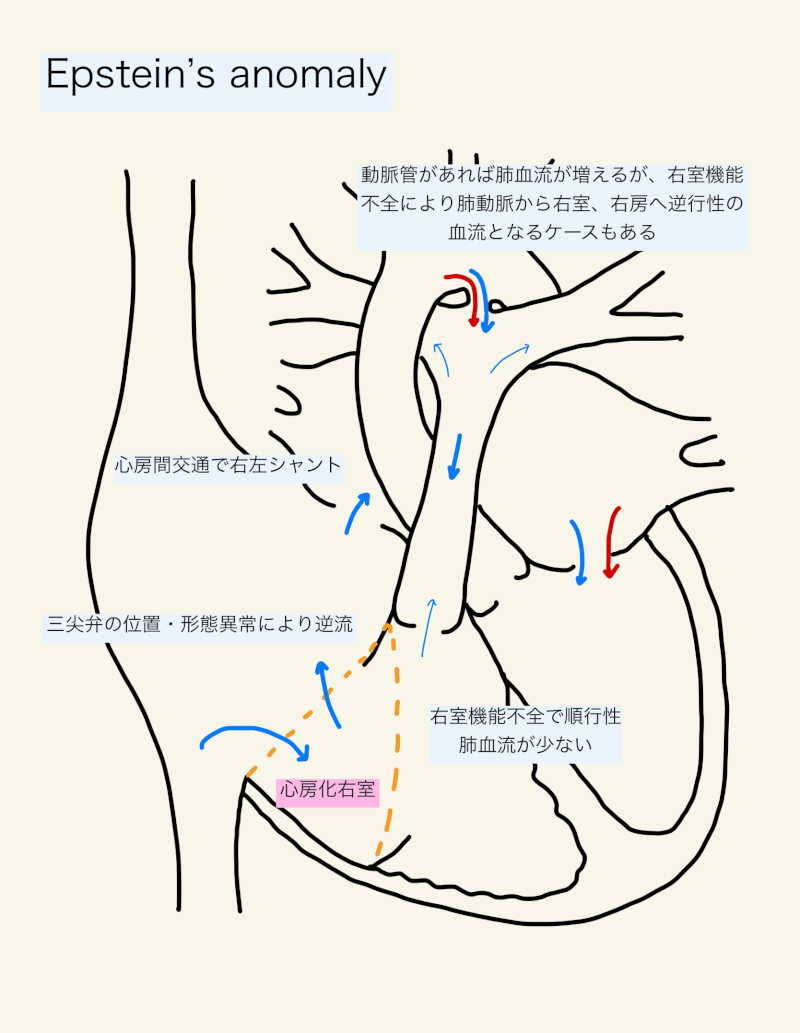
エブスタイン奇形の重症度は、三尖弁逆流・右室機能・心房間交通の大きさ(制限・非制限)に依存する。
三尖弁の形態的変化が強く重度の逆流がある場合、右室の拍出機能は低下する。心房間交通が大きく非制限的であれば、特に出生直後の肺血管抵抗が高い時期は心房レベルで右左シャントとなり、チアノーゼを呈するが左室の心拍出量は保たれる1)。動脈管が開いていれば、動脈管を介して肺血流が得られるが、右室の拍出機能が低下しているため動脈管からの血流に対抗できず、右室からの順行性肺血流を認めない(機能的肺動脈閉鎖:functional pulmonary atresia)ことがある1,3)。肺血管抵抗が小さくなるに従い、肺血流が増え、徐々にチアノーゼは軽くなる。
肺動脈弁閉鎖不全を合併している場合、大きな動脈管は「circular shunt」として知られる高心拍出性心不全を引き起こす。これは、血液が大動脈から動脈管を通って、逆行性に主肺動脈、右室、右房、心房間交通、左房、左室から大動脈に流れてしまい、肺毛細血管床への灌流が少なくなる現象である1)。
心房間交通が小さく制限的であれば、心室中隔の位置異常と奇異性運動により左室機能が障害され、左室の心拍出量が低下しうる。左室の形態学的な発達が止まり、著名な肉柱形成を伴い機能不全に陥る「左室緻密化障害(non-compaction)」を呈する1)。
三尖弁の形成不全が軽度で逆流が少ない場合は、成人まで無症状のまま経過することもある。しかし、三尖弁逆流は徐々に増悪し、右房の拡大と心房化右室の菲薄化により心拡大は進行する3)。
エブスタイン奇形は不整脈を合併しやすい。心房粗動、心房細動、発作性上室性頻脈は患者の25-30%に発生し、その他にも様々な電気生理学的異常所見が観察される1)。
方針
(解剖学的)肺動脈閉鎖、circular shunt、プロスタグランジン依存、コントロール不良なチアノーゼや心不全、Carpentier type C/Dといった重症患者では、新生児期の手術が必要となる3,11)。一方で、三尖弁異常による進行性右心不全、右室形成不全、その他の右心系閉塞性病変がない限り、早期の外科的介入は不要である1)。
乳児期を生き延びた患者の予後は良く、症状が出るまで手術を延期することが可能である11)。ただし、三尖弁や右室機能の更なる悪化の予防し長期予後を改善するため、早期に外科的介入が行われることがある1)。小児期以降の手術適応としては、増悪する心拡大(機能的右室を右室側に組み込むことで拡張と線維化を予防)、運動耐容能の低下、奇異性塞栓、新規の心房・心室性不整脈が挙げられる3)。
最終的なゴールとして
- 二心室修復
- 単心室(Fontan手術)
- One-and-a-half ventricle repair
- (心移植)
のどれを目指すか決める。
二心室修復
可動性のある三尖弁前尖、大きさの保たれた機能的右室、Carpentier type A/Bといった患者が対象となる3)。
二心室修復を目指す術式として幾つか存在するが、基本的には三尖弁の形成と心房中隔欠損の閉鎖を行う。例えば、Cone手術では三尖弁尖を切離し本来の三尖弁輪に逢着しすることで円錐型の三尖弁を形成し、心房化右室を長軸に縫縮する(longitudinal plication)1)。Carpantier手術は、三尖弁前尖と後尖を中心に利用した三尖弁形成術である。
単心室
新生児期には三尖弁輪が小さく人工弁を使用できない。一般的に、右室機能が強く障害されている場合には、最終的には単心室循環(Glenn手術とFontan手術を参照)をゴールとして考える。例えば、機能的右室が小さい、三尖弁の形態異常が強い、三尖弁逆流の流速<3m/s、右室収縮期圧<30mmHgといった患者が含まれる3)。
Starnes 手術は右室に頼らず(RV exclusion)三尖弁を閉鎖する手術である。古典的には自己心膜パッチで三尖弁を閉鎖(fenestrationなし)し、伝導系への損傷を避けるため冠動脈洞はexclusionされた右室側に残された8)。修正Starnes手術では、三尖弁に孔を開けたパッチ(fenestrated patch)を留置することで、右室のdecompression(直接心臓内に還流するthebesian veinsからの血液が右室に充満し左室を圧迫することを予防)を可能とする。同様の理由で冠動脈洞は右房側に残すこともあるが、(二心室を見据えた場合に右室の成長を促すために)右室側へ還流させることもある10)。また、拡張した右室の一部を切除してvolume reductionを行い、拡張期の左室への圧迫を阻止する方法(Sano RV exclusion procedure7))もある。非制限性になるよう心房間交通を大きく開け、modified Blalock-Taussing shunt (mBTS)などで肺血流を確保する1)。Circular shuntや心原性ショックのある新生児に対し、血行動態を安定させる有効な手術である。
Starnes手術は単心室循環を念頭においた術式であったが、のちに二心室修復へのconversionが可能であることが明らかとなった。すなわち、不安定な血行動態や弁形成が難しいと考えられる患者、機能的右室の大きさが境界線にあるような患者において、最初にStarnes手術を行い、のちに(ex. 1歳未満前後)二心室またはone-and-a-halfの可能性を評価することは妥当である9)。二心室を見据えた場合のStarnes手術(staged management)では、三尖弁のfenestrationed patchだけでなく、冠静脈洞の還流部位、BCPC時の肺動脈のfenestrationed patch等、右室の成長を考慮する必要がある10)。
one-and-a-half(1.5心室)
低形成の右室であっても肺動脈へ血液を部分的に駆出できる場合もあるので、その場合はone-and-a-half ventricle repair(純肺動脈閉鎖とGlenn手術を参照)を考える。
One-and-a-half ventricle repairには、1) 主肺動脈への拍動性血流のために主要体肺側副動脈(Major aortopulmoary collateral artery: MAPCA)が形成されにくい、2) Fontan循環よりも需要に応じて心拍出量を増加しやすいといった利点がある1)。
術前チェック項目
胸部レントゲン検査では、著明な心拡大による”box-shaped heart” を呈する。心拡大により肺が圧迫され、肺低形成を呈することがある3)。
心エコーで
- 三尖弁(中隔尖、後尖、前尖)の形態・位置異常・逆流の部位・重症度:重症例では弁の位置異常により接合(coaptation)が悪い。
- 前尖の大きさ:”sail-like” anterior leaflet
- 右室拡張末期容量:重症例の機能的右室は小さい
- 右室の収縮力、三尖弁逆流圧較差:右室の収縮能力の評価。低い圧較差は不十分な機能的右室を示唆。
- 右室流出路狭窄:前尖の異常腱索や中隔尖・後尖の位置異常が右室流出路狭窄を引き起こす
- 左室機能:緻密化障害
- 心房間交通:制限 or 非制限。右左シャントは不十分な機能的右室を示唆
- 肺動脈弁:解剖学的肺動脈閉鎖と機能的肺動脈閉鎖があり得る
- 動脈管:functional pulmonary atresiaやcircular shuntに関与
- Celermajer Index:新生児期の重症度と予後の予測5)
= (右房 + 右房化右室)/(右室 + 左室 + 左房)
※四腔像の拡張末期で計測した面積
※Grade 1: <0.5, Grade 2: 0.5-0.99, Grade 3: 1-1.49, Grade 4: >=1.5
を評価する。
周術期管理
術前管理
チアノーゼを呈した新生児は、肺血管抵抗を低下させ機能的右室からの順行性肺血流増加・右左シャント減少を目指す。酸素投与・やや低二酸化炭素・アシドーシス回避・無気肺予防・低い気道内圧(陰圧呼吸)など、一般的な対策をとるる。NOにより肺血流を増やすことで、肺血流の低下が機能的か解剖学的かを判断するために有用となる1)。
しばしば、動脈管開存を維持し肺血流を増加させるために新生児期早期にプロスタグランジンが必要となる。しかし、circular shuntではプロスタグランジンを中止し動脈管が小さくなることで、このシャントが減少し、高心拍出性心不全が改善する1)。また、機能的肺動脈閉鎖の状態においても、プロスタグランジンを中止し順行性の肺血流を増加させる意義がある3,6)。
= Prenatal diagnosis of tricuspid regurgitation=
エブスタイン奇形の他に、器質的な肺動脈閉鎖・狭窄や、機能的肺動脈狭窄症の可能性がある。したがって、診断が確定するまでは肺血流を保つために生後すぐにプロスタグランジンを開始し、PICUに搬送してもらう。
心エコーで肺動脈弁に異常なく十分な順行性血流を認めた場合には、プロスタグランジンの投与を中止する。動脈管依存性の肺血流の可能性もあるため、動脈酸素飽和度低下に注意する。肺動脈弁に異常がある場合にはプロスタグランジンが必須となる。純型肺動脈閉鎖の周術期管理や肺動脈閉鎖/心室中隔欠損症/主要体肺側副動脈の周術期管理を参照。
三尖弁逆流のみであれば、生理的な肺血管抵抗低下により逆流は徐々に改善する。可能であれば、生後6週以内の手術は避け、体重増加を待って2歳以降の手術が望ましい。
術中管理
エブスタイン奇形患者は右室の拍出が弱いため、十分な前負荷を必要とする。麻酔薬による血管拡張、相対的volume lossには十分注意し、適宜輸液・輸血で対応する。
Cone手術では、修復術中の右冠動脈損傷が、II, III, aVFのST上昇や、鏡像としてのI, aVLの低下により明らかとなることがある1)。大動脈遮断解除後の完全房室ブロック、洞不全、房室接合部調律となることがあり、ペーシングが必要となる1)。右心系が拡張した症例・右室縫縮(plication)が行われた患者では、修復術後致死的不整脈が起きる危険性が高い1)。
人工心肺離脱後も、右室の順行性血流を増加させるため、十分な前負荷と心血管作動薬による補助が必要となる。
術後管理
Cone手術では、縫合線が乖離しないように気をつける。すなわち、右房を拡張させるような急な容量負荷を避け、咳嗽や息堪えによる右房圧上昇を予防するために数日間鎮静することも考慮する。心室機能や三尖弁逆流の程度により、術後の呼吸器離脱や心血管作動薬の離脱を判断する。
エブスタイン奇形修復術後、不整脈に苦慮することが多い。上室性頻拍、房室接合部調律、間欠的房室ブロック、心室性不整脈など様々な不整脈が起こりうる1)。一時的ペーシングや、リドカイン・アミオダロンといった抗不整脈薬の投与を考慮する。心筋浮腫が改善するにつれ、機能的伝導路の回復とともに洞調律に復帰することもある1)。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- Transesophageal Echocardiography for Pediatric and Congenital Heart Disease, 2nd Edition. Pierre C. Wong et al. DOI: https://doi.org/10.1007/978-3-030-57193-1.
- Sainathan S, et al. J Thorac Dis. 2020 Mar;12(3):1161-1173. PMID: 32274197.
- Carpentier A, et al. J Thorac Cardiovasc Surg. 1988 Jul;96(1):92-101. PMID: 3386297.
- Celermajer DS, et al. J Am Coll Cardiol. 1992 Apr;19(5):1041-6. PMID: 1552092.
- Wald RM, et al. Am J Cardiol. 2005 Sep 15;96(6):851-6. PMID: 16169376.
- Sano S, et al. Eur J Cardiothorac Surg. 2014 Mar;45(3):549-55; discussion 555. PMID: 24186924.
- Starnes VA, et al. A new surgical approach. J Thorac Cardiovasc Surg. 1991 Jun;101(6):1082-7. PMID: 2038202.
- Konstantinov IE, et al. J Thorac Cardiovasc Surg. 2024 Aug;168(2):311-324. PMID: 38685467.
- Konstantinov IE, et al. J Thorac Cardiovasc Surg. 2024 Jul;168(1):e5-e8. PMID: 37926199.
- Kron IL, et al. Ann Cardiothorac Surg. 2017 May;6(3):266-269. PMID: 28706870.

コメント
コメント一覧 (1件)
[…] エブスタイン奇形(+ 三尖弁逆流症) […]