以下、心室中隔欠損症(Ventricular Septal Defects: VSD)の血行動態・周術期管理に際し、麻酔科医・集中治療医が把握すべき事項を解説します。
解剖・分類
VSDの分類方法は、幾つか存在するが、その一つを紹介する。大動脈下型のI型、膜性部周囲型のII型、流入型のIII型、筋性型のIV型である1)。I〜III型は三尖弁と肺動脈弁の近傍のVSDであり、IV型は心室中隔のより心尖部側にある筋性部のVSDである。
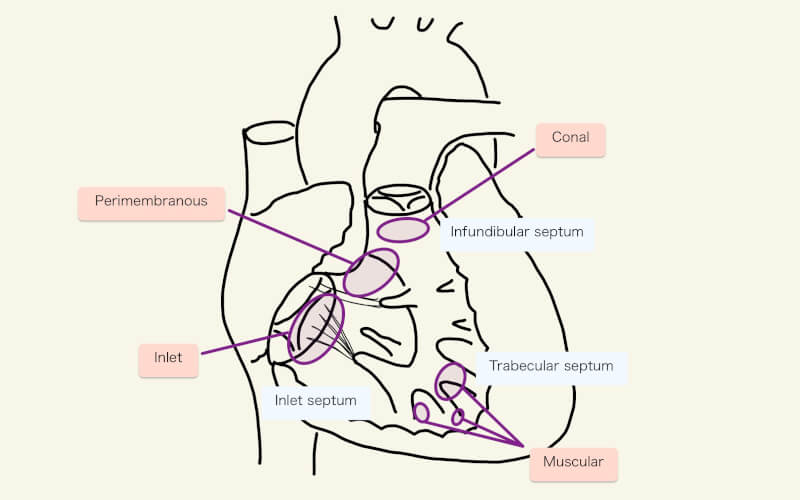
大動脈下型
I型(大動脈下型:subarterial)は、肺動脈弁下型(subpulmonary)、両大血管下型(doubly committed)、稜上型(supracristal)、conal、漏斗部型(infundibular)ともよばれる。この位置の欠損孔はベンチュリー効果によって、血流ジェットを引き起こし、大動脈弁の右冠尖・無冠尖がVSDの方向へ逸脱し、閉鎖不全を引き起こす1)。
膜性部周囲型
II型(膜性部周囲型:perimembranous/infracristal/paramembranous)は最も一般的なVSD。”Peri”であり、膜様部中隔だけでなくその周辺、例えば大動脈弁の右冠尖や左冠尖まで及ぶことがある6)。瘤状の三尖弁組織(aneurysmal tricuspid valve tissue)が存在し欠損孔を部分的または完全に閉塞させることもある6)。
流入型
III型(流入型:Inlet/AV canal/endocardial cushion)は、三尖弁直下の流入部心室中隔の欠損。AVSDと関連することもある1,2)。
筋性型
IV型(筋性型:muscular)は肉柱に覆われているため境界や大きさがとらえにくく、正確な術前診断が困難のことがある。
漏斗部中隔 [infundibular (conal) septum]と肉柱部中隔(trabecular septum)が空間的にズレる(malalignment)、malalignment VSDという概念もある6)。
– 前方偏位型:大動脈がVSDに騎乗するファロー四徴症や両大血管右室起始症で、右室流出路の狭窄や肺動脈弁の低形成をきたす6)。
– 後方偏位型:左室流出路の狭窄や大動脈弁の低形成を合併し、大動脈縮窄や離断症と関連する6)。
病態生理
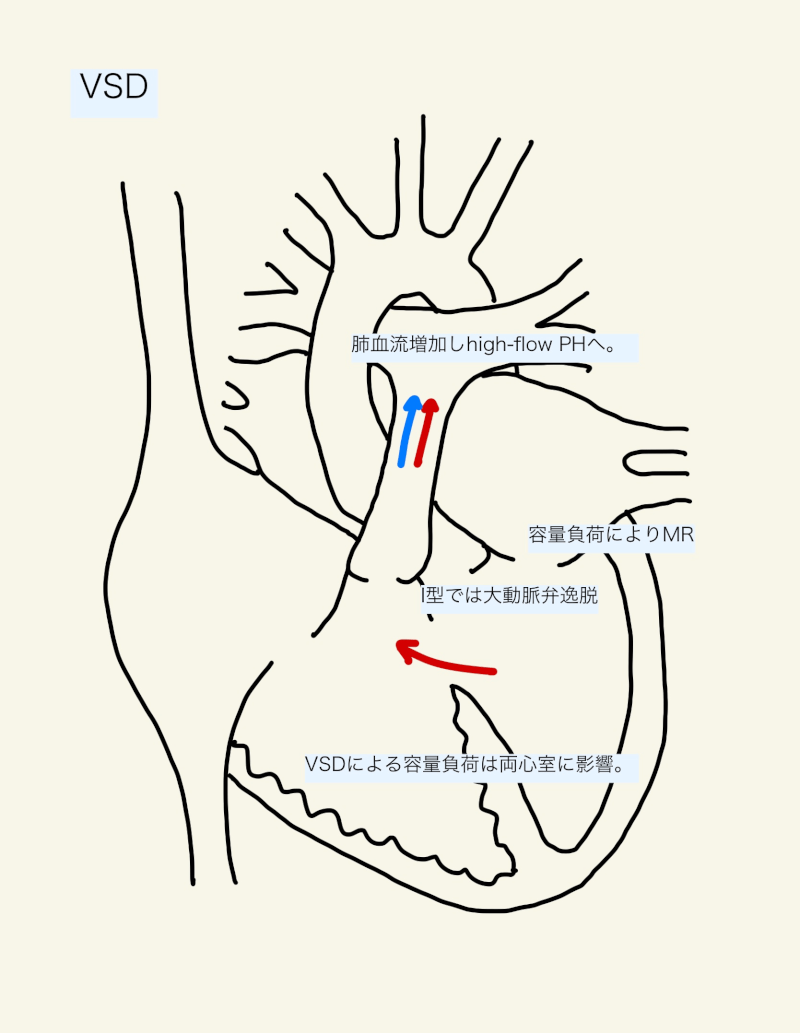
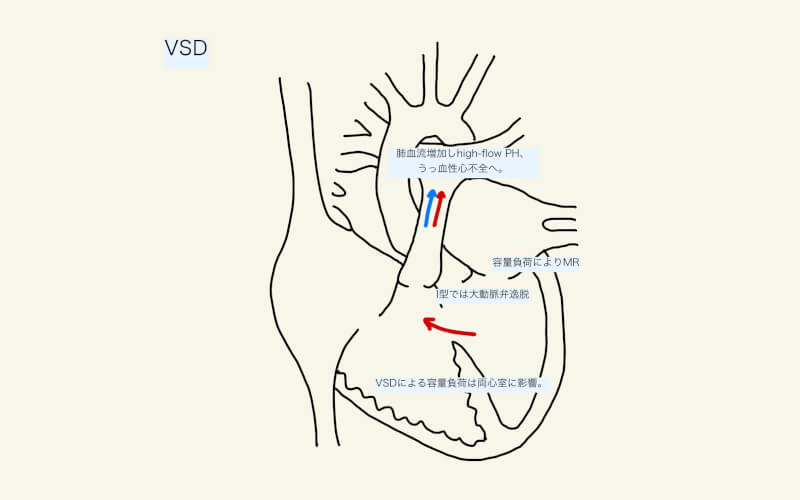
VSDは、主に収縮期に心室レベルの左右シャントとなる。左右シャントにより肺血流が増加(High-flow)し、肺高血圧症を呈する。左室は体血流(Qs)だけでなく、増加した肺血流(Qp)も拍出しなければならず、うっ血性心不全となる。
心房中隔欠損症では容量負荷による心室拡大は右室に限定されたが、VSDによる容量負荷は両心室に影響を与える。
VSDは、シャント量がその孔のサイズにより制限を受ける欠損孔の小さなrestrictive VSDか、シャント量がその孔のサイズによって制限を受けない欠損孔の大きなnon-restrictive VSDになりうる1)。
たとえnon-restrictive VSDとなるような大きなVSDであっても、肺血管床と全身血管床の相対的な抵抗の差(比)により、欠損孔を介した圧較差は存在する。non-restrictive VSDでは、シャント量は肺血管床と全身血管床の相対的な抵抗の差(比)に依存する。
シャントや容量負荷による変化に加え、構造的も引き起こす。例えば、大動脈弁近傍のVSD(I型)ではしばしば大動脈弁が逸脱し、大動脈弁閉鎖不全症を引き起こす。容量負荷により左室の拡大が強い場合は、僧帽弁輪も拡大し僧帽弁逆流が生じる。
病状の進展は、患者の年齢、欠損孔の大きさ、左右シャント量に依存する。non-restrictive VSDの場合は、肺血管抵抗が生後早期に生理的に低下するため、生後3ヶ月頃までにうっ血性心不全の症状が出現する1)。
長期にわたり肺血流増加・肺高血圧が続いた場合、肺血管抵抗が増加し始める。2歳までに不可逆的なEisenmenger症候群となることがあり、欠損孔の大きな非制限VSDは2歳までに治療する1)。一方で、特に小さな膜性部周囲型と筋性型VSDの50%は自然閉鎖し、一般的に無症状である1)。
外科的治療
肺動脈絞扼術
(2kg以下などの)低体重児や症状を呈しているが右房切開アプローチが難しい患者では、患者が大きくなり経右房的に修復が可能となるまで、肺動脈周囲にバンドを掛けることでシャント量・肺血流量を減らし、体重が増加するのを待ってから根治術へ向かう。
パッチ閉鎖
通常の根治術では、人工心肺下にパッチを用いてVSDを閉鎖する。
外科的修復術のタイミングは、年齢や症状・徴候の重症度によって異なる。内科的コントロールに難渋するうっ血性心不全、成長障害や体重増加不良、肺血流量の増加(Qp/Qs↑)による肺高血圧症、VSDによる大動脈弁の逸脱や大動脈弁閉鎖不全症(I型)、感染性心内膜炎のリスクなどから判断する。
術前チェック項目
心エコーでは、
- 大動脈弁閉鎖不全:VSD(I型)に合併する大動脈弁の変形。人工心肺中の心筋保護に影響
- 左室拡張末期容量、僧帽弁逆流の有無:左心系の容量負荷の指標
- 左房のサイズ:左右シャントが多いと大きくなるが、小さいと高い肺血管抵抗や術後肺高血圧クライシスのリスクを想起させる。
- 駆出率:長期の容量負荷で心収縮力が低下
- 三尖弁逆流圧較差:肺高血圧の推測
- 三尖弁逆流:VSD閉鎖後と比較するため
を評価する。
心臓カテーテル検査が施行されている場合は、
- Qp/Qs
- 肺血管抵抗、体血管抵抗
- 肺血圧、体血圧
も把握しておく。
その他、
- 21トリソミーの有無:肺高血圧症は、特に21トリソミーの患者で進行しやすい。術後の肺高血圧クリーゼの可能性も高くなる。
周術期管理
術前・術中管理
基本的にVSDで手術になるような患者は、肺血流量が増えた肺高血圧(High-flow PH)の状態であることが殆どである。そのため、肺血管抵抗を増加させる(低下させない)管理が肝要である。
肺血管抵抗が増加しEisenmenger症候群となった患者の管理は、これとは全く異なるので注意すること。
麻酔導入時は、気道系の危険とのバランスであるが、通常はFiO2 0.4-0.6で導入を開始する(高酸素や低二酸化炭素になると、Qpが増えて心不全となる)。ただし、21トリソミーの患者では巨舌により気道確保が困難となる可能性があり注意が必要である。挿管後はFiO2を最小限にし、低二酸化炭素を避けるべきである。
人工心肺離脱後
TEEを用いて、残存VSDや心腔内空気、心室内容量や心室機能を評価する。
- 筋性VSDは、大きなVSD修復後に明らかとなる場合があるので注意を要する。残存VSDによる左右シャントが疑わしければ、採血によりQp/Qsを計算することができる。特に心尖部に近い小さな欠損孔は、外科的修復が困難な場合もあり、再度人工心肺装置を用いて開心するリスクの方が高く、経過観察することもある。
=Fickの原理=
Qp/Qs=(Sat Ao – Sat MV)/(Sat PV – Sat PA)
※Sat Ao: 大動脈酸素飽和度、Sat MV: 混合静脈血酸素飽和度、Sat PV: 肺静脈酸素飽和度、Sat PA: 肺動脈酸素飽和度
- パッチ縫縮では術後の三尖弁逆流に注意する。
- 動脈下型のVSDでは、術前の軽度の大動脈弁逆流はVSD閉鎖のみで消失する場合もあるが、TEEで評価する。
- 人工心肺離脱直後は僧帽弁逆流を認めても、容量負荷が減るに従い逆流が減ることがある。
術前肺血流が著明に増加していた患者や、長期間肺血流増加に曝された患者、21トリソミーの患者では、人工心肺の影響も加わり人工心肺離脱後に肺高血圧症となる可能性がある。肺高血圧症を呈した場合、人工心肺離脱前や術後に吸入NOが必要となることがある。
伝導障害は一時的・永久的両方ありうる。心房切開による心房性不整脈や、パッチ縫縮による刺激伝導系の傷害・房室ブロックに注意する。ブロックが発生した場合は、一時的ペーシングワイヤーを留置する。異所性接合部頻拍(Junctional epitopic tachycardia: JET)は1歳未満の患者で多く、特にファロー四徴症のVSD閉鎖術後にみられる1)。
術後管理
左心不全
残存VSDがない限り閉鎖後のQp/Qsは1に低下する。人工心肺の影響、術前の左室容量負荷、術後の急激な左心系の前負荷減少、肺循環への短絡血流消失による後負荷の増加により、術後は左心不全傾向となる。適宜、強心剤、輸液・輸血、血管拡張薬を使用する。
右心不全・肺高血圧
術前に肺血流が著名に、長期間増加していた患者では、肺血管のリモデリングにより肺血管抵抗が上昇している5)。人工心肺の影響も加わり、術後は肺高血圧を呈し、右心不全となることがある。また、右室切開によるアプローチを行った際には、術後右心不全が悪化する。
これらの患者では、体液バランスを最適化することが大切である。過少であると術後の低心拍出量症候群に寄与してしまうが、過剰であると右室が左室を圧迫し、やはり心拍出量は低下する3,4)。術前に肺が”wet”であることも考慮し、術後は利尿剤などを用いて(急激な変化ではなく)徐々にマイナスバランスを目指す必要がある。
肺高血圧を呈した患者では、何らかの刺激により肺高血圧クライシスが引き起こされることがある。リスクの低い単純VSDは、手術室・ICU入室早期抜管の良い適応ではあるが、リスクの高い患者では、筋弛緩薬を併用した鎮静・人工呼吸管理も考慮する。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- Pediatric Cardiac Anesthesia, fourth edition. Carol L. Lake. Peter D. Booker.
- Hill NS et al. Respir Care. 2009 Jul;54(7):958-68. PMID: 19558745.
- Hoeper MM et al. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1114-24. PMID: 21700906.
- Chan SY et al. Compr Physiol. 2011 Jan;1(1):123-39. PMID: 23737167
- Transesophageal Echocardiography for Pediatric and Congenital Heart Disease, 2nd Edition. Pierre C. Wong et al. DOI: https://doi.org/10.1007/978-3-030-57193-1.
コメント
コメント一覧 (7件)
[…] 人工心肺復温中の体肺動脈シャントを試験的に開通させた際、平均体血圧の有意な低下が認められず、離脱後早期は脈圧が小さく拡張期圧が高いときに、Qp/Qsの低下を疑う。術野からの動脈ドップラーや、Fickの法則を用いたQp/Qsの計算[Qp/Qs=(Sat Ao – Sat MV)/(Sat PV – Sat PA)]によって確認することもできる。 […]
[…] 心室中隔欠損症、房室中隔欠損症 etc)や単心室循環(ex. 単心房/単心室、三尖弁閉鎖(Ic, […]
[…] 心室中隔欠損症(Ventricular septal defects) […]
[…] その他の中隔欠損(ex. VSD)と同様、肺血管抵抗と体血管抵抗のバランスをとり、肺循環血流量を制限することが大切である。例えば、麻酔導入時はFiO2 0.4-0.6と低めの酸素濃度で導入を開始する。ただし、21トリソミーの患者など気道に不安がある場合は注意が必要である。挿管後はFiO2を最小限にし、低二酸化炭素を避けるべきである。 […]
[…] 肺動脈狭窄のない両半月弁下VSDや大動脈弁下VSD型のDORVは、VSDと同様の生理学を呈す。 […]
[…] 動脈管結紮前は、肺血管抵抗を上昇させて左右シャントを減らす管理(「心室中隔欠損症の周術期管理」参照)とする。麻酔導入時は、気道系の危険とのバランスであるが、通常はFiO2 0.4-0.6で導入を開始する。挿管後はFiO2を最小限とするが、左肺の換気はほとんど行われないため、しばしば酸素濃度の上昇が必要となる。肺血流の観点からも低二酸化炭素は避けるべきである。 […]
[…] 上記の他にも、残存VSDの有無もチェックする。チェック方法などの詳細については「VSDの周術期管理」を参照。 […]