以下、左心低形成症候群(Hypoplastic left heart syndrome:HLHS)とNorwood手術(ノーウッド手術)の血行動態・周術期管理に際し、麻酔科医・集中治療医が把握すべき事項を解説します。
解剖
HLHSは、左室が低形成となる一連の疾患を指し、上行大動脈や大動脈弓は低形成となり、大動脈弁や僧帽弁の重度の狭窄または閉鎖を伴う。
病態生理
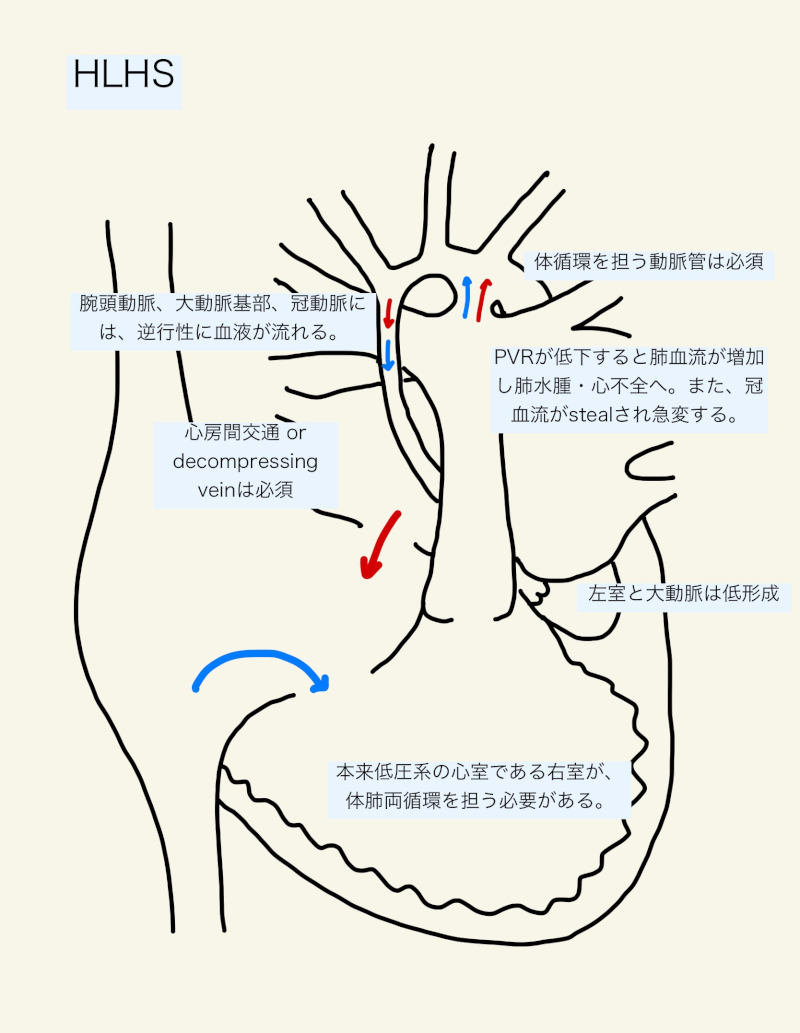
血液は肺静脈から左房へ還流し、心房中隔を介して拡大した右房と右室へ流入する。右室が体循環と肺循環の両方の心拍出を担う。血液は肺動脈からの動脈管を通して大動脈に流入し、体循環を供給する。腕頭血管、大動脈基部、冠動脈には、逆行性に血液が流れる。ただし、大動脈狭窄症ではある程度の順行性血流を認める。
未治療では、動脈管が狭小化・閉鎖するにつれ体循環と冠動脈への血流が消失し、灌流低下・乳酸アシドーシス・呼吸不全を発症する。従って、生存のためにはPGE1を投与し動脈管の開存を維持しなければならない。QpとQsには繊細なバランスが存在し、Qp/Qsが1に近い状態1)(または1よりもやや少なめ3))が肺と全身への十分な灌流維持のために最適とされている。
循環を維持するためには、肺静脈血を左房から逃がすための心房間交通や減圧血管(decompressing vein)が必須である。一方で、肺静脈還流をある程度制限している状態も、Qp/Qsを低下させるという点では大切である1)。例えば、ある程度心房間交通が制限された状態(ex. 大きさ<3mm、平均圧較差>5mmHg)は肺血流を抑制し、術前にプラスに働く可能性がある10)。逆に、制限のない心房中隔欠損や肺静脈還流異常症でシャント量が多い場合は、Qp/Qsが高くなる。
生後数時間から数日で肺血管抵抗が減少するにつれQp/Qsが2-3程度にまで増加する1)。結果、過剰肺循環となり、肺間質・肺胞浮腫、頻呼吸、陥没呼吸から呼吸不全となる。FiO2を増加させ過換気にすることは、肺血管抵抗を更に低下させ、肺血流増加・肺水腫を増悪させる。
また、Qp/Qsの増加によって体循環血流の「盗血」現象が起こり、全身や冠動脈への血流が減少し、低灌流と乳酸アシドーシスを伴う心原性ショックとなる。体循環からの盗血により、腸管虚血や壊死性腸炎が術前に発症することもある1)。
方針
HLHSの基本的な外科的治療としては、大きく分けて3つのstageに分けて考えることができる。
- Stage 1(生後1週): Norwood手術
- Stage 2(6ヶ月前後): 両方向性大静脈肺動脈吻合(Glenn手術)
- Stage 3(約3歳): 総大静脈肺動脈吻合(Total CavoPulmonary Connection: TCPC/ Fontan手術)
Stage 1: Norwood手術
大動脈弓の再建
肺動脈は横断され、近位部の肺動脈弁を新生大動脈弁として使用し、上行大動脈をホモグラフトパッチや直接吻合で再建する。右室流出路から大動脈基部と冠動脈、そして体循環に血液が流れることになる。左室があり上行大動脈の直径が大きい場合、比較的末梢側で肺動脈と結合することで「上肢の酸素飽和度(左室からの血流)>下肢の酸素飽和度(右室からの血流)」となることがある。上行大動脈の直径が小さい場合は、大動脈基部で隣接する種肺動脈に吻合することが多いが、冠動脈への影響に留意が必要である。
同時に、肺動脈の切断遠位部を縫合し、心房レベルでの十分な左右シャントとなるよう、心房中隔切除術を施行する。
肺血流の確保
肺血流を確保するために、体動脈肺動脈短絡(modified Blalock-Taussing shunt: mBTS)か、右室肺動脈導管(RV-PA couduit / Sano shunt)を用いる。
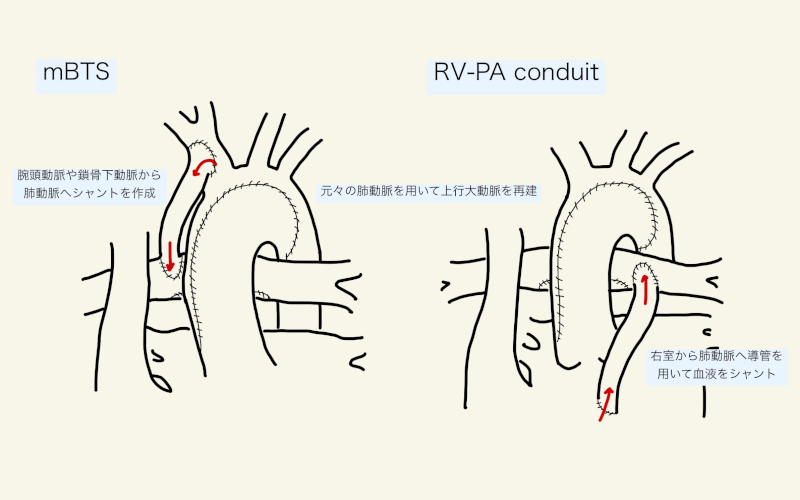
mBTS(3.0-4.0mm)を用いた場合は、体循環から肺動脈への持続的run-offとなるため、肺血管抵抗が減少するにつれ体循環から盗血され、拡張期の冠血流が減少し循環虚脱となる危険がある。
一方、RV-PA couduitを用いた場合には、導管が新生大動脈弁よりも近位(右室)から起始することで拡張期の肺動脈へのrun-offがないため、拡張期圧が高く冠動脈虚血が減るという利点がある。一方、右室切開による心室機能障害や不整脈といった懸念がある。例えば、体重<2.5kgで4mm、2.5-4kgで5mm、4kg以上やPVRが高い症例(ex. PVOやASD狭小化)では6mmを用いる11)。
mBTS vs. RV-PA conduit
それぞれの利点・欠点については様々な議論がある。
- 術早期はmBTSの方が死亡率が高く、全体で言えばRV-PA conduitの方が合併症が多い4)。
- Shunt typeはNorwood術後死亡の独立危険因子ではない5)。
- mBTSの方が肺血管が育ちやすいかもしれない4)。
- 左心系単心室では心室切開による導管留置がしづらい。
Hybrid procedure
上記のようなNorwood手術ではなく、両側肺動脈絞扼術と動脈管にステント(またはPGE1投与)を組み合わせる“Hybrid”と呼ばれる方法がある。
- 不安定な血行動態、未熟児、低出生体重児、合併症のある患者や、
- 大動脈離断や重度大動脈弁狭窄症(または左室流出路狭窄)があり、一期的に二心室修復ができるか不明な患者の、段階的手術
- 左室の大きさがborderlineの患者に対するLV recruitment
として、選択されることがある。新生児期の人工心肺や循環停止の回避、左室の成長促進、単心室または二心室の決定を遅らせることができる、といったメリットがある7)。HLHSに対しては、両側肺動脈絞扼術後1-2ヶ月でNorwood手術を行う”rapid two-stage Norwood”や、生後4-6ヶ月時に、Norwood手術+Glenn手術を行う方法がある。
State 2&3: Glenn手術とFontan手術
Glenn手術とFontan手術に関しては、単心室循環の他の病態でも同様であるため、別記事で扱う。
Hypoplastic left heart complex (HLHC)
HLHSの延長上の疾患として、”Hypoplastic left heart complex”という用語が用いられることがある。大動脈弁と僧帽弁の低形成(狭窄や閉鎖なし)、左室低形成、左室流出路低形成、上行大動脈と大動脈弓の低形成(±大動脈縮窄症)から成る。上行大動脈には順行性の血流があることが特徴となる8)。Borderline left ventricleとして考えられるが、全身循環への狭窄病変が解除されれば左室が成長し、二心室修復が見込まれる。
二心室修復のための心房間交通に関しては、様々な考え方がある。左右シャントのある心房間交通を閉鎖することで、左室が充満、心拍出量が増加し、左室が成長する。しかし、心房間交通を完全に閉鎖すると、コンプライアンスの低い左室に急激に血液が全て還流することになるため、左室の過負荷と拡張を引き起こし、左室機能不全と左房圧上昇を呈する。そのため、心房間交通を部分的に閉鎖(fenestration)により左室の充満を助け、同時に負荷に対して左室が適応する時間を稼ぐ方法もある。例えば、心房間交通 2-3mm、圧較差を5-8mmHgとし、両肺動脈絞扼術と動脈管による全身循環を維持することで二心室修復を可能とした報告もある9)。
術前チェック項目
心エコーでは、
- 房室弁(三尖弁)の形態や逆流の程度:単心室循環における房室弁逆流は、患者の術後管理や予後に深く関係する。
- 右室拡張末期容量や駆出率:右室であるが、体循環を支える心室となる。
- PDAの開存:生存には必須。
- 心房中隔欠損:左房のdecompressionができているか。
- 肺静脈還流異常:左房のdecompressing veinとして。
- 上行大動脈の太さ:上行大動脈が低形成(ex. 2mm以下)では、冠動脈への血流が不安定となり、循環動態の破綻を来す原因となる1)。
- 上行大動脈の血流方向:大動脈閉鎖(AA)であれば逆行性、大動脈狭窄(AS)の程度によっては順行性の血流がある。
- その他の合併奇形:大動脈縮窄症、左室への冠動脈瘻1) etc
をチェックする。
cf. 心臓カテーテル検査
現在、大部分のHLHSは胎生で診断され、Norwood手術を行うまでに心臓カテーテル検査が行われることはあまりない。
周術期管理
HLHSは胎生期に診断され、小児心臓領域に精通した施設で出産することが多い。小児科、心臓外科、臨床工学技士、看護師、麻酔科の立会いの元、帝王切開術が施行される。
特に、胎児エコーで心房間交通やdecompressing veinが無い(または小さい)と判断された場合は、出生直後に経皮的バルーン心房中隔裂開術(Balloon arterial septostomy: BAS)や開胸・人工心肺補助下に心房中隔裂開術、ECMO (extra-corporeal membrane oxygenation)が必要となることもある。そのため、出生前より各科の密なコミュニケーションが必要である。
海外では、このような緊急のBASやECMOを生後すぐに施行しなければ生きられない患者は後の予後不良であることから、生後数時間以内は内科的管理のみしか行わない施設もある。
術前管理
自発呼吸下で高めのPaCO2によりQp/Qsを「自己調節」している状態が、新生児期の術前として最適の状態である1)。近年、殆どのHLHSは術前人工呼吸管理とならず、room air下に自発呼吸で管理される。多くの患者は、初めの数日で肺血管抵抗が減少し肺間質の浮腫が起きるにつれ、頻呼吸と陥没呼吸が進行する。術前利尿薬は、肺を通して再循環する血液容量を制限するために有用である1)。nasal CPAPは、自発呼吸のまま陽圧により呼吸負荷を軽減し肺血管抵抗を上昇させることができる。
人工呼吸管理下で窒素を用いてFiO2未満にまで下げる管理法は、全身と脳の酸素化を有意に低下させるため廃れつつある2)。気管挿管と機械換気は、重症呼吸不全や不十分な心房間交通の存在などにより肺血流が著明に減少している患者に適応となる。高PEEP、高二酸化炭素、必要に応じて鎮静薬や筋弛緩薬を使用する。
全身血管抵抗を下げるためにミルリノンといった薬剤を選択する施設もあるが、調節性の良さからニトロプルシドといった短時間作用型の拡張薬を好む施設もある。
可能であれば、Qp/Qsが大きく崩れる前の早期の手術が望ましい。
循環のためには動脈管の開存と心房間交通が不可欠である。ただし、ある程度の順行性血流を認め動脈管が両方向性シャントである場合は、プロスタグランジンによる肺血管抵抗低下によりQp/Qsが上昇し(PMID 7637184)、循環不全となる可能性もある。
麻酔導入・維持
殆どのHLHS新生児が過剰な肺血流状態にあるので、過換気や高濃度酸素といった肺血管抵抗を下げるような呼吸管理を避けるべきである。空気や低濃度酸素で導入を開始する。二酸化炭素を吸入させる方法もある2)。
脳灌流のため人工血管を介した腕頭動脈送血が行われるため、頭部血圧のモニタリングとして右上肢に動脈圧ラインを確保する。動脈管や下行大動脈送血による灌流圧確認のために大腿動脈に動脈圧ラインを確保する。患児が将来も手術を受けることを考慮し、可能であれば初回手術では臍カテーテル(または大腿静脈)を用いることで、胸部中心静脈穿刺・カテーテル挿入による血栓形成を防ぐ。また、術後は内頚・鎖骨下中心静脈カテーテルの代わりに経胸心房ラインを用いる。
Norwood手術(RV-PA conduit)の一例
- 腕頭動脈に人工血管を立て、腕頭動脈送血・右房脱血で人工心肺確立
- 動脈管に送血管を追加し全身冷却
- 動脈管の送血管を抜去、動脈管結紮、主肺動脈切離
- Conduitと肺動脈を吻合
- 腕頭動脈経由で冠動脈への血流が期待できればbeatingで、上行大動脈が細くて難しければ心筋保護液投与、心停止。腕頭動脈からの部分的脳灌流※。
- 大動脈形成
- 心停止、右房切開、心房間交通拡大
- 遮断解除し冠動脈への血流再開、自己心拍再開
- Conduitと右室を吻合
- 人工心肺離脱、MUF
※日本では腕頭動脈に人工血管を吻合して部分的脳灌流を行うことが多いが、欧米では超低体温完全循環停止下で大動脈弓形成を行うこともある12)。また、動脈管(循環停止が必要)または下行大動脈(循環停止を回避)からの送血の選択も、施設によって異なる。
人工心肺離脱後
人工心肺終了後、肺循環はmBTSかRV-PA conduitに依存している。一般的には、低-正常PaCO2、FiO2 0.5(-1.0)で換気を開始するが、個々の患者の状態によって調節が必要である。Norwood手術は、単心室に対する容量や圧負荷を軽減する訳ではない。Qp/Qs 1.0を目標とする並行体肺循環は、術後も同様である。
体血流を保つ
前述の通り、原則としてNorwood術後も体循環と肺循環のバランスを調節することが課題となる。低酸素血症により心臓が動かなくなることは稀であるが、体血流量の低下は冠血流量の低下により急変につながる。
心拍出量(Qp+Qs)低下により、全身への心拍出量(Qs)が減少している場合には、肺血流を制限する前に心拍出量を正常化する必要がある。適切な前負荷や心血管作動薬の使用により心拍出量を維持した後、体血流を保つために肺血管抵抗を維持し、体循環・冠血流を確保する。特にmBTSで大きな脈圧と拡張期低血圧を呈している場合は、Qp/Qsが増加しているため、肺血管抵抗を増加させる管理とする。
基本的には、体・冠血流を保つ必要があるため、酸素↓、二酸化炭素↑(低換気)といった呼吸器の条件によって肺血管抵抗を維持する管理が多い。
一方で、様々な操作による肺血管抵抗の変化や経時的変化は調節が難しいとし、血管拡張薬やNOを用いて肺血管抵抗を最大限低下させ、それ以上の肺血管抵抗の急激な低下を防ぎ、クリップなどにより外科的(物理的)に肺血流を調節するという施設もある。
低酸素血症を防ぐ
Norwood術後の低酸素血症の原因として、1) 混合静脈血酸素飽和度低下、2) 肺静脈酸素飽和度低下、3) Qp/Qs低下が考えられる1)。
1) 混合静脈血酸素飽和度低下
全身酸素供給の低下により混合静脈血酸素飽和度が減少し、単心室循環であるためそのまま体循環に流れ低酸素血症となる。
SvO2 ≒ SaO2 – VO2 / (Hb×1.39×CO×10)
Modified ultrafiltration (MUF)によって血液を濃縮し、酸素供給を増加させることで、全身酸素飽和度は上昇する。また、強心薬や血管拡張薬により心拍出量を増やすことで混合静脈血酸素飽和度が上昇する。
Qp/Qs低下が原因でない時に肺血管抵抗を減少させると、容量負荷から心不全となるので注意が必要である。
2) 肺静脈酸素飽和度低下
無気肺予防し肺胞でのガス交換を促進する。術野より肺が膨らんでいるかチェックし、経食道心エコーで胸水がないか確認する。
3) Qp/Qs低下
人工心肺復温中の体肺動脈シャントを試験的に開通させた際、平均体血圧の有意な低下が認められず、離脱後早期は脈圧が小さく拡張期圧が高いときに、Qp/Qsの低下を疑う。術野からの動脈ドップラーや、Fickの法則を用いたQp/Qsの計算[Qp/Qs=(Sat Ao – Sat MV)/(Sat PV – Sat PA)]によって確認することもできる。
大動脈再建やmBTSなどの技術的問題、肺血管抵抗の過度な上昇が原因となる。術前に心房間交通やdecompressin veinのないため肺静脈狭窄となった患児では、非常に高い不安定な肺血管抵抗を呈する。Qp/Qsを増加させる方法としては、より大きなシャントの作成といった外科的介入、呼吸器設定やNOなどで肺血管拡張療法、ノルアドレナリンなどの体血管収縮薬がある。
心機能の低下
HLHSでは、右室が体肺両循環を担う必要があり、心機能の低下をきたしやすい。人工心肺の影響、超低体温循環停止といった虚血時間による悪影響に加え、大動脈閉鎖により通常の心筋保護法が困難であった場合、大動脈再建による冠血流の低下、新生大動脈弁狭窄・逆流、房室弁機能不全、残存大動脈弓閉塞性病変などが、心機能低下の原因として挙げられる1)。また、RV-PA conduitを用いた場合は、右室切開による心機能低下も危惧される。
典型的には、主要な心臓手術を施行された患児の心機能は術後6-12時間で最も悪化し、その後改善し始める1)。拡張不全(Restrictive physiology)となった場合には、一回拍出量を確保するためにはある程度の充満圧(filling pressure)が必要となる。場合によっては心房圧12-15mmHgまでは許容する。輸液が必要となるが、ノルアドレナリンなどで静脈還流を増やす場合もある。
残存病変を評価
経食道心エコーで残存病変を評価する。
Major Residual Region6)の例
- 弓部再建近位部狭窄:peak velocity >3.2m/s
- 弓部再建遠位部狭窄:peak velocity >2.5m/s
- 心房間交通:mean gradient >4mmHg
- 新生大動脈弁逆流:中等度以上
その他
Norwood手術は主に心臓外の手術であるため、術前から存在しない限りブロックは稀であり、復温過程の早期に発生した不整脈、特に心室性不整脈は冠動脈が原因であることが多い1)。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- Tabbutt S et al. Circulation. 2001. Sep 18;104(12 Suppl 1):159-64.
- Barnea O et al. Circulation. 1998. Oct 6;98(14):1407-13.
- Ohye R et al. N Engl J Med. 2010 May 27;362(21):1980-92.
- Tabbutt S et al. J Thorac Cardiovasc Surg. 2012 Oct;144(4):882-95.
- Nathan M, et al. J Am Coll Cardiol. 2021 May 18;77(19):2382-2394. PMID: 33985683.
- Sojak V, et al. Eur J Cardiothorac Surg. 2019 Jul 1;56(1):110-116. PMID: 30753393.
- Corno AF. Eur J Cardiothorac Surg. 2005 Jan;27(1):67-73. PMID: 15621473.
- Daebritz SH, et al. Thorac Cardiovasc Surg. 2002 Oct;50(5):266-70. PMID: 12375181.
- Photiadis J, et al.Eur J Cardiothorac Surg. 2005 Jun;27(6):962-7. PMID: 15896602.
- 小沼武司. 左心低形成症候群(HLHS)の外科治療における術式の変遷. Pediatric Cardiology and Cardiac Surgery 40(1):3-8 (2024).
- Ohye RG, et al. J Thorac Cardiovasc Surg. 2009 Apr;137(4):803-6. PMID: 19327499.
コメント
コメント一覧 (9件)
[…] TAは、三尖弁の完全な欠損で右房と右室の連絡がない先天性心疾患である。そのため、右室は流入部が欠損し、肉柱部が不完全なと右室低形成となる。左心低形成症候群(HLHS)が右室型単心室に分類されるのに対し、TAは左室型単心室に分類される。先天性心疾患の0.5-1%を閉め、type I, II, IIIへ分類される1)。 […]
[…] 三尖弁閉鎖、左心低形成症候群、単心房/単心室 […]
[…] Norwood手術→Glenn手術→Fontan手術を参考のこと。 […]
[…] たとえNowood術後(並行循環が継続し密な管理が必要)であっても、成長過程によりmBTSなどのシャントは相対的に小さく制限的となり、肺血管抵抗を下げるような操作でも過剰な容量負荷となりにくい。また、術前肺血管抵抗は低いため、それ以上は肺血管抵抗は大きく低下せず、Qp/Qsの変化は小さい1)。すなわち、高酸素濃度での導入も耐えられることが多い。 […]
[…] 上記は基本的に孤発性ASDの病態生理である。左心低形成症候群、三尖弁閉鎖症、総肺静脈還流異常症、純肺動脈閉鎖症といった、心房中隔欠損孔がないと生存できない疾患もあり、それぞれを参照してほしい。 […]
[…] 左心低形成症候群(Hypoplastic left heart syndrome:HLHS) […]
[…] 左心低形成症候群と三尖弁閉鎖症に関しては、それぞれをご覧ください。 […]
[…] また、左心低形成症候群、大動脈縮窄/心室中隔欠損、大動脈離断症/心室中隔欠損といった、動脈管によって体循環が成り立っている場合にも、両側の肺動脈絞扼術(bilateral PA banding)を施行することにより体循環を保つことが可能となる。 […]
[…] 私が研修医だった頃はまだまだドパミン全盛期でした。しかし、徐々に臨床研究におけるドパミンの旗色が悪くなり、使用する頻度は減ってきました。私がいた日本の施設でも、10年前までは小児心臓手術の立ち上げではドパミンが第一選択でした。しかし、当時心臓血管外科教授であった佐野俊二先生(←「Sano shunt」を世に広めた人ですね)の「海外ではそんなの使わないんだよ」という鶴の一声で、成人だけでなく小児領域でも当施設から排除されてしまいました。 […]