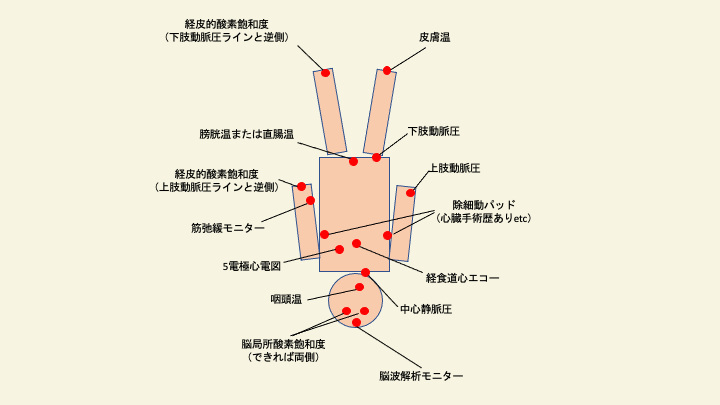
以下、小児心臓麻酔に使用される主なモニタリングについて、麻酔科医・集中治療医が把握すべき項目を解説します。
ライン
動脈圧ライン
小さな患児の動脈圧ライン挿入部位は,橈骨動脈や大腿動脈が選択される。上腕動脈は末梢側へ血液を供給するが,側副血行路が乏しいことから血栓や虚血性変化による合併症が危惧され、動脈の挿入部位として避けられることが多い。しかし,その合併症の頻度や重症度が他の部位と比べて明らかに多いかは明らかでない2,3)。
右上肢の血圧は腕頭動脈経由で頭部の血圧のモニタリングとしても用いることができる。Norwood手術や選択的脳灌流(Isolated cerebral perfusion: ICP)などで腕頭動脈からの送血が必要な手術,左鎖骨下動脈が遮断される可能性がある手術では,右上肢に動脈圧ラインを確保する。
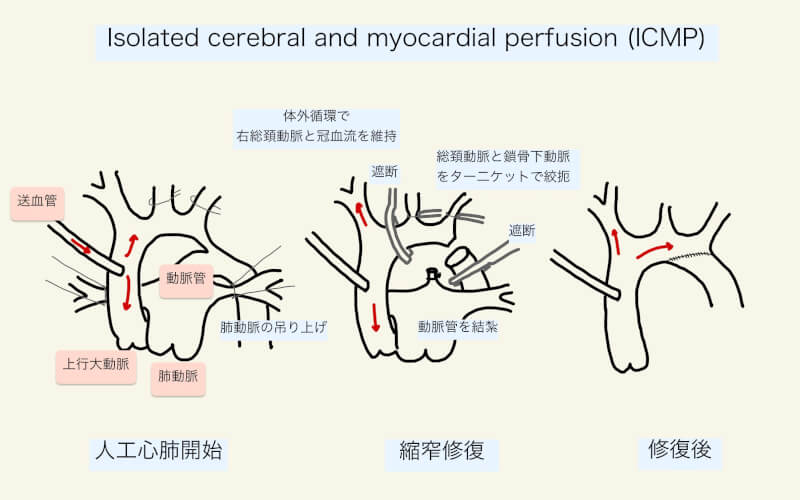
また,Blalock-Taussingシャント(BTシャント)造設予定,または既にBTシャントが留置されている患者では,血圧モニタリングのためにBTシャントと逆側の上肢に動脈圧ラインを留置する。
動脈圧測定は一箇所でも小児心臓麻酔は可能であるが、上下肢の二箇所(ex. 橈骨動脈と大腿動脈)をモニタリングできると有用である場面は多い。例えば、
中心静脈圧ライン
中心静脈カテーテルは,右内頸静脈を選択することが多いが,モニタリングしたい圧と合併症のリスクを常に考える必要がある。例えば,Glenn手術やFontan手術では術後上大静脈は肺動脈圧のモニタリングとして使用できるが,血栓形成による還流障害は循環を破綻させる可能性がある。細いカテーテルの使用,太い静脈の選択,大腿静脈や術野からの心房ライン(後述)の使用も考慮し,可能な限り短期間の留置を心がける。
小児では血管が細く、複数回の手術歴のある患者では血管確保が困難であることも多いため、複数ルーメンの中心静脈カテーテルは有用である。しかし、ルーメン数が増えカテーテルが太くなるに従い、カテーテル関連血流感染や血栓症の危険が増える4,5)。
中心静脈カテーテル先端が上大静脈に位置している場合,中心静脈血酸素飽和度(ScvO2)を評価できるというメリットもある(「Fickの原理とQp/Qs」参照)。ScvO2で混合静脈血を代用することで,酸素の需要(VO2)と供給(DO2)のバランスをモニタリングすることも可能である(「先天性心疾患の酸素需要と酸素供給」参照)。
中心静脈ラインの太さ、深さの例
– 2.5kg未満:内頚静脈への留置を避け、大腿静脈に末梢用ラインを挿入 or 心房ラインを使用
– 2.5kg以上&10kg未満:4Fr・5cmのカテーテルを根元まで留置
– 10kg以上:5Fr・8cm カテーテルを根元まで留置
※内経静脈カテーテルの深さの目安:身長<100cm⇒[(身長/10) – 1] cm、身長>=100cm⇒[(身長/10) – 2] cm
※抜けない程度に挿入し、術野で適切な長さにカットする方法もある。
心房圧ライン
完全大血管転位に対する大動脈スイッチ手術や先天性大動脈弁狭窄症術後など、体心室機能に不安がある症例では、術野から心房ラインを挿入することがある。心房圧をモニタリングでき、人工心肺離脱後や術後の心機能評価に使用できる。また、Glenn手術やFontan手術後では、「肺動脈圧(=中心静脈圧) – 心房圧」で計算されるtranspulmonary pressure gradientは、肺血管抵抗の目安として用いられる。Norwood手術後など、皮下トンネルを経由した心房ラインであれば中心静脈ラインとして比較的長期に使用することもある。
肺動脈圧ライン
小児心臓麻酔では、その小さな体格や心内シャントの存在などから肺動脈カテーテル(Swan-Ganzカテーテル)の使用は適さない6)。術中であれば術野からの直接穿刺により肺動脈圧を一時的に知ることは可能である。
体温
成人の心臓手術は軽度低体温や正常体温で施行される傾向にあるが,小児心臓手術では低体温や超低体温循環停止(Deep hypothermic circulatory arrest: DHCA)が用いられている。これは,外科的手技の観点から低流量や循環停止を要する手術が少なくなく、酸素供給不全による脳をはじめとした臓器保護を目的としている。そのため,小児心臓麻酔では代謝に深く関与する体温のモニタリングも重要である。
中枢温として、咽頭温と直腸温や膀胱温をモニタリングする。咽頭温は脳に近く,特に復温時の脳高体温による神経障害を防ぐために重要である7,8)。人工心肺中、咽頭冷却よりも直腸冷却が先行する場合、ポンプ血流が脳に灌流していない可能性があり、送血管の位置異常を疑うサインとなる24)。
末梢温として皮膚温をモニタリングする。低心拍出量状態では交感神経系の亢進により末梢血管が収縮し,中枢温と末梢温の差(Core peripheral temperature gradient: CPTG)が拡大すると言われている9,10)。しかし,末梢温には室温や加温器,モニタリング部位など様々な因子が関与すると考えられ,温度較差の単一マーカーとしての有用性には疑問もある11,12)。
近赤外線分光器
小児心臓手術後の神経学的合併症の発生率は2-25%と高い13)。対策の一つとして、非侵襲的な連続モニタリングである近赤外線分光法(Near-infrared spectroscopy: NIRS)を用いて、周術期に脳組織における酸素供給の評価を行う。
国内で臨床使用可能なNIRSデバイスとして、O3(Masimo社)、INVOS(Somanetics社)、NIRO(浜松ホトニクス社)などが存在するが、発光器やセンサー,動静脈の比率,アルゴリズムが異なるため、それぞれのデバイスで計測された絶対値を互換的に用いることはできない14,15)。また,成人と小児では光伝搬と光学的な性質が異なる16)ため,小児に対し成人用センサーで代用するのではなく,適切なセンサーを選択する必要がある17)。
脳酸素飽和度(ScO2)の正常値は対象患者やデバイスによって異なるが,先天性心疾患のある患者では低いことが多い18)。ScO2は脳の酸素需要供給バランスを表していると考えられるが,脳の酸素供給量(DO2)や酸素消費量(CMRO2)を直接測定しているわけではない。ScO2は混合静脈血酸素飽和度と関連し19)、先天性心疾患患者の予後と関連したとの報告もあり20)、全身の酸素需要供給バランスの連続モニタリングとしても期待される。
人工心肺中は、送血管の位置異常により、片側性の脳灌流や下行大動脈のみへの灌流が起こりうる。近赤外線分光法による両側脳酸素モニターにより、カニューラの位置異常による血流パターン異常の早期発見が可能となる23)。
経食道心エコー
経食道心エコー(Transesophageal echocardiography: TEE)は,術前診断の修正や人工心肺離脱後再導入など,10%以上の症例で術式やその後の管理に影響を与えると報告されており21),小児の心臓麻酔において非常に重要なモニタリングの一つである。一般的に,気管食道瘻,食道閉鎖,消化管穿孔,消化管出血,気道トラブルでは禁忌とされる1)。
小児,特に新生児など体格の小さな患者では,TEEプローブ挿入による気道や循環動態の変化に注意が必要である。例えば,
全ての症例において,プローブ挿入前後の血行動態や最大気道内圧の変化に注意すべきである。不必要に挿入するのではなく、必要に応じて経食道ではなく術野からの評価に変更するなどの柔軟な対応が望ましい。また、残存病変は生存日数を含めた予後悪化と関連する22)ため,人工心肺離脱時には小児循環器科医や資格ある専門家による評価が望ましい。
References
- Anesthesia for Congenital Heart Disease, 3rd Edition. Dean B. Andropoulos et al.
- Singh A, et al. Brachial Arterial Pressure Monitoring during Cardiac Surgery Rarely Causes Complications. Anesthesiology. 2017 Jun;126(6):1065-1076. PMID: 28398932.
- Scheer B, et al. Crit Care. 2002 Jun;6(3):199-204. PMID: 12133178.
- Templeton A, et al. Infection. 2008 Aug;36(4):322-7. PMID: 18663408.
- Geerts W. Hematology Am Soc Hematol Educ Program. 2014 Dec 5;2014(1):306-11. PMID: 25696870.
- Lemson J, et al. Pediatr Crit Care Med. 2012 Mar;13(2):250-1. PMID: 22391851.
- Grigore AM, et al. Anesth Analg. 2009 Dec;109(6):1741-51. PMID: 19923500.
- Engelman R, et al. J Extra Corpor Technol. 2015 Sep;47(3):145-54. PMID: 26543248.
- Aynsley-Green A, et al. Arch Dis Child. 1974 Jun;49(6):477-81. PMID: 4212503.
- Murdoch IA, et al. Acta Paediatr. 1993 Sep;82(9):773-6. PMID: 8241676.
- Butt W, et al. Anaesth Intensive Care. 1991 Feb;19(1):84-7. PMID: 2012301.
- Kimura S, et al. J Cardiothorac Vasc Anesth. 2022 Mar;36(3):690-698. PMID: 34119417.
- Andropoulos DB, et al. Anesth Analg. 2004 Nov;99(5):1365-1375. PMID: 15502032.
- Yoshitani K, et al. Anesth Analg. 2002 Mar;94(3):586-90; table of contents. PMID: 11867380.
- Chung J, et al. J Vasc Res. 2020;57(6):341-347. PMID: 32894846.
- Fukui Y, et al. Appl Opt. 2003 Jun 1;42(16):2881-7. PMID: 12790436.
- Dullenkopf A, et al. Paediatr Anaesth. 2003 Jun;13(5):384-91. PMID: 12791110.
- Kurth CD, et al. Ann Thorac Surg. 2001 Jul;72(1):187-92. PMID: 11465176.
- Rescoe E, et al. J Thorac Cardiovasc Surg. 2017 Sep;154(3):1056-1062. PMID: 28599970.
- Kimura S, et al. Pediatr Cardiol. 2023 Apr 8. PMID: 37029812.
- Bettex DA, et al. Anesth Analg. 2003 Nov;97(5):1275-1282. PMID: 14570637.
- Nathan M, et al. J Am Coll Cardiol. 2021 May 18;77(19):2382-2394. PMID: 33985683.
- Gottlieb EA, et al. Paediatr Anaesth. 2006 Jul;16(7):787-9. PMID: 16879523.
- Kern FH, et al. Ann Thorac Surg. 1992 Oct;54(4):749-54. PMID: 1417234.
コメント